
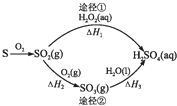
| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
分析 A.固态硫的能量低于液态硫,所以液态硫燃烧放热多;
B.中和反应的定义:强酸与强碱的稀溶液混合生成1mol水放出的热量为中和热;
C.二氧化硫与三氧化硫都能够与碱溶液反应生成盐和水,属于酸性氧化物;
D.△H1是二氧化硫与双氧水反应的焓变△H4、双氧水分解的焓变△H5之和,根据盖斯定律:△H4=△H2+△H3,则双氧水分解的焓变△H5=△H1-(△H2+△H3),据此判断双氧水分解的焓变即可.
解答 解:A.硫在固态时具有的能量小于液态,则固体硫单质燃烧放出的热量小于293.23 kJ/mol,故A正确;
B.含l mol H2S04的浓溶液与足量NaOH反应生成2mol水,且浓溶液溶于水放热,所以该反应放出的热量不是中和热,故B错误;
C.二氧化硫和三氧化硫对应的酸分别为亚硫酸、硫酸,则二氧化硫与三氧化硫均属于酸性氧化物,故C正确;
D.由于△H1<△H2+△H3,说明△H1是二氧化硫与双氧水反应的焓变△H4、双氧水分解的焓变△H5之和,根据盖斯定律△H4=△H2+△H3,则双氧水分解的焓变△H5=△H1-(△H2+△H3)<0,焓值小于0,说明2H2O2(aq)═2H2O(l)+O2(g)为放热反应,故D正确,
故选B.
点评 本题考查较为综合,涉及化学反应吸热与放热的判断、酸性氧化物和中和热的概念等知识,题目难度中等,明确 化学反应与能量变化的关系为解答关键,D为易错点,注意△H1是二氧化硫与双氧水反应的焓变△H4、双氧水分解的焓变△H5之和,试题培养了学生的分析能力及灵活应用能力.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
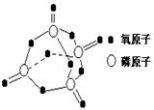 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-(CH2)11C6H4-SO3Na | B. | CH3-(CH2)13-COOK | ||
| C. | CH3-(CH2)11-SO3Na | D. | CH3(CH2)nCH3(5≤n≤12) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3与Al(OH)3都能够作为治疗胃酸过多的药品 | |
| B. | 可以用铝制器皿盛放浓硫酸和浓氢氧化钠溶液 | |
| C. | 医院里用高锰酸钾溶液和双氧水来消毒,是因为两者有某种共同的性质 | |
| D. | 在水中投入适量的氢氧化钠固体可以增大明矾的净水效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com