
| A、Fe和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | ||||
| B、Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | ||||
C、用石墨做电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O |
| ||


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
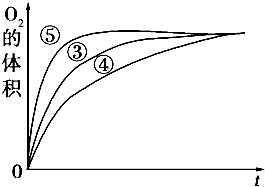 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业制硫酸、工业制硝酸、由石英获取单晶硅变化均为氧化还原反应 |
| B、氧化反应与还原反应一定同时发生,但氧化剂、还原剂可不直接接触 |
| C、置换反应肯定都是氧化还原反应,但复分解反应可能是氧化还原反应 |
| D、氧化还原反应中氧化产物与还原产物不会再发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe粉中混有Zn粉杂质(稀H2SO4) |
| B、FeCl2中混有FeCl3杂质(Cl2) |
| C、CO气体中混有CO2杂质(NaOH溶液) |
| D、FeCl3中混有FeCl2杂质(铁屑) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4、NaCl、NaHCO3均属于强电解质 |
| B、SO2、NO2、NO均属于二次污染物 |
| C、NaHCO3、NH4Cl、(NH4)2CO3三种固体受热后均无固体剩余 |
| D、FeCl2、NaHSO3、Fe(OH)3都可以通过化合反应直接制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com