

分析 (1)根据核外电子排布规则判断,同主族从上到下第一电离能逐渐减小;
(2)依据图示可知X为CO,SiO2和焦炭反应生成碳化硅和CO;
(3)根据四氯化硅中Si原子的价层电子对数判断杂化类型和键角;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子;原子晶体熔沸点的高低取决于共价键的稳定性;
(5)依据晶胞计算方法计算即可.
解答 解:(1)基态Si原子电子排布式为1s22s22p63s23p2,则基态硅原子核外未成对的电子数为2,同主族自下而上第一电离能逐渐减小,因此第一电离能:C>Si,
故答案为:2;Si;
(2)SiO2和焦炭反应生成碳化硅和CO,化学方程式为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO;
故答案为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO;
(3)SiCl4中Si原子的价层电子对数为4+$\frac{1}{2}$(4-4×1)=4,没有孤电子对,硅原子采用sp3杂化,为正四面体结构,故Cl-Si-Cl键的键角为109°28′;
故答案为:sp3;109°28′;
(4)晶体硅中最小的为六元环,含有6个原子,SiC与硅晶体相似,因此也含有6个原子,两者都是原子晶体,结构和组成相似,Si-Si键长大于Si-C键长,Si-Si键能小,晶体硅的熔沸点低于碳化硅,
故答案为:6;二者均为原子晶体,结构和组成类似,Si-Si键键长大于Si-C键键长,故Si-Si键键能小,导致晶体硅的熔点低于碳化硅;
(5)SiC中,C位于顶点和面心,故C为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si位于晶胞的中心,故Si为4,那么该晶胞即为Si4C4,即l mol SiC中含有4mol共价键,故分解l mol SiC形成气态原子所需要的能量为4akJ,
故答案为:4a.
点评 本题考查化学方程式的书写和电子排布规律、第一电离能、化学键、杂化类型、分子结构和空间构型、晶胞计算等知识,综合性强,为物质结构常规考题形式,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
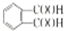 .
.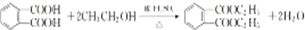 .
.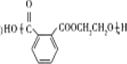 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
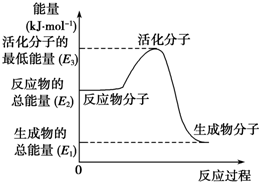 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是| A. | 上述图示的反应为吸热反应 | |
| B. | 图中的能量变化如图所示,则△H=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据①②推知:在25℃、101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于676.7 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
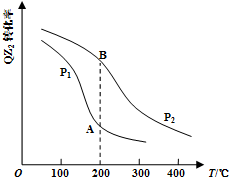 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答: .
.| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有O2 | B. | 肯定只有NH3和NO | ||
| C. | 肯定有NH3、NO、HCl | D. | 肯定没有Cl2、NH3、NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com