
【题目】常温下,向1L0.1molL-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法正确的是
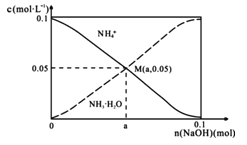
A.M点溶液中水的电离程度比原溶液大
B.在M点时,n(OH-)-n(H+)=(a -0.05)mol
C.随着NaOH的加入,![]() 不断增大
不断增大
D.当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
【答案】B
【解析】
试题分析:常温下,向1L0.1molL-1NH4Cl溶液中不断加入固体NaOH发生反应:NH4Cl + NaOH ==NaCl + NH3·H2O。A、NH4Cl溶液中铵离子水解,促进水的电离,M点溶液为氯化铵、氯化钠和一水合氨的混合液,一水合氨抑制水的电离,故M点溶液中水的电离程度比原溶液小,错误;B、在M点时,溶液为氯化铵、氯化钠和一水合氨的混合液,根据电荷守恒知n(H+)+n(Na+)+n(NH4+ )=n(OH-)+n(Cl-),n(Na+)=amol,n(Cl-)=0.1mol,n(NH4+ )=0.05mol,则n(OH-)-n(H+)=(a -0.05)mol,正确;C、铵离子的水解平衡常数Kh=c(H+)c(NH3·H2O)/c(NH4+ ),随着NaOH的加入,NH3·H2O 浓度不断增大,温度不变,Kh不变,c(H+)/c(NH4+ )不断减小,错误;D、当n(NaOH)=0.05mol时,溶液为等浓度的氯化铵、氯化钠、一水合氨的混合液,溶液呈碱性,一水合氨的电离程度大于铵离子的水解程度,离子浓度大小关系为:c(Cl-) >c(NH4+)>c(Na+)>c(OH-)>c(H+) ,错误。


科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1~100nm之间
D.胶体一定条件下能聚沉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用下列装置进行乙醇催化氧化的实验,请回答下列问题:
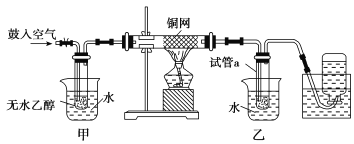
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式
__________________________________________。
熄灭酒精灯,不断地鼓入空气,反应仍能继续进行,说明乙醇的催化氧化反应是_______反应。
(2)甲和乙两个水浴作用不相同,甲的作用是_____________;乙的作用是_____________。
(3)反应进行一段时间后,集气瓶中收集到的气体的主要成分是__________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中含有_______,要除去该物质,可先在混合液中加入________(填字母序号),然后再通过________(填操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)将20mLNO2和NH3的混合气体,在一定条件下充分反应,化学方程式是:6NO2+8NH3![]() 7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是
7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是
A. 3∶2 B. 2∶3 C. 3∶7 D. 3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B. 苯乙烯在合适条件下催化加氢可生成乙基环己烷
C. 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3能使湿润的淀粉KI试纸变蓝。实验室可用如图装置制取ICl3(夹持装置省略)。
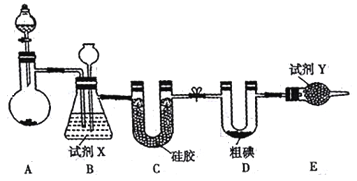
(1)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为_________。
(2)试剂X、Y分别是_______、_______。
(3)装置B的作用是:_______;装置E的作用是:_______。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为______。
(5)某同学欲测定ICl3 样品中ICl3的纯度,他准确称取ICl3样品10.00g于烧杯中,加入适量水和过量KI晶体,充分反应(样品中杂质不反应),反应的化学方程式为__________,将所得溶液配制成100mL待测液,取25.00mL待测液,用2.000mol·L-1的Na2S203标准液滴定(I2 +2S2O32-=2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为_______,重复滴定3次,测得消耗Na2S203溶液体积的平均值为20.00mL。该样品中ICl3的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
有机物G(分子式C13H18O2)是一种香料,下图是该香料的一种合成路线。

已知:①E能够发生银镜反应,l mol E能够与2mol H2完全反应生成F;
![]()
③有机物D的摩尔质量为88g/mol,分子式为C4H8O2,其核磁共振氢谱有3组峰:
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B:_____________________________。
(2)E的结构简式为:__________________________________。
(3)C与新制的Cu(OH)2悬浊液反应的化学方程式为:___________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液所需试剂为:__________。
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F是同分异构体;③能被催化氧化成醛。符合上述条件的甲有_________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6:2:2:l:1的有机物的结构简式为________________。
(6)以丙烯为原料合成D的路线如下:

X的结构简式为:________________________,步骤II的反应条件为:________________。步骤IV的反应类型为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有共价键的化合物必是共价化合物
B. 阴、阳离子间通过静电引力所形成的化学键是离子键
C. 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D. 液态氯化氢中存在H+和Cl-,所以能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com