
| A. | Zn为正极,碳为负极 | |
| B. | Zn为负极,碳极发生氧化反应 | |
| C. | 工作时,电子由碳极经过电路流向Zn极 | |
| D. | 长时间连续使用时,内装糊状物可能流出腐蚀用电器 |
分析 A.原电池中,失电子的电极作负极,据此判断;
B.干电池工作时,负极上发生氧化反应,正极上得电子发生还原反应;
C.电流从正极经外电路流向负极;
D.根据糊状物的性质分析,NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性.
解答 解:A、锌失电子而作负极,碳为正极,故A错误;
B、锌失电子而作负极,负极上发生氧化反应,碳为正极,发生还原反应,故B错误;
C、干电池工作时,电流从正极碳经外电路流向负极锌,故C错误;
D.NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性,所以干电池长时间连续使用时内装糊状物可能流出腐蚀电器,故D正确;
故选D.
点评 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | c(X2)=0.2 mol/L | B. | c(Y2)=0.1 mol/L | C. | c(Z2)=0.4 mol/L | D. | c(Y2)=0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表的七个周期永远不会改变 | |
| B. | 元素周期表有九个横行,分为七个周期 | |
| C. | 元素周期表有十八个纵行,分为十六个族 | |
| D. | 元素周期表有十八个纵行,分为十八个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可通过酸性高锰酸钾溶液来区别乙烷和乙炔 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 | |
| D. | 棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深再变浅 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 合成氨时高温、高压对合成氨有利 | |
| D. | 醋酸溶液稀释时,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

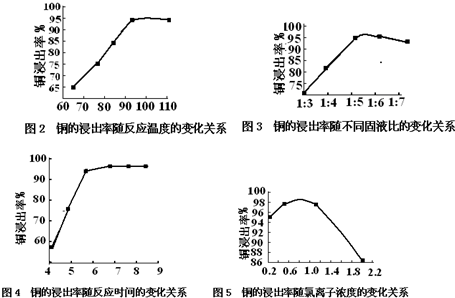
| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com