

| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
分析 (1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;制取的氯气中含有氯化氢杂质,依据氯气和氯化氢气体的性质选择合适的除杂剂,结合装置中气体压强变化分析现象;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(3)氯气的氧化性强于溴,溴的氧化性强于碘,据此解答.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;制取的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择饱和食盐水吸收氯气中的氯化氢,装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 除去Cl2中混有的HCl;B中长颈漏斗中有水柱上升;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d;
故答案为:d;
(3)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄,所以现象为:溶液从无色变化为橙色;
溴单质的氧化性强于碘单质,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;
故答案为:橙; 氯单质的氧化比溴单质强;液体分为两层,上层液体显紫红色.
点评 本题考查了氯气的制备和性质的检验,侧重于学生的分析能力和实验能力的考查,把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
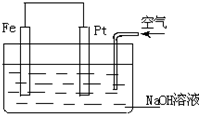
| A. | 这是一个原电池的装置 | |
| B. | 这是电解NaOH溶液的装置 | |
| C. | Pt为正极,其电极反应为:2H++2e-═H2↑ | |
| D. | Fe为负极,其电极反应为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一时间内消耗 2n mol X的同时生成 n mol Z | |
| B. | c(X):c(Y):c(Z)=2:1:1 | |
| C. | 容器内气体的总物质的量不再变化 | |
| D. | 容器内原子总数不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①②③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com