
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 工业上电解饱和食盐水的阴极反应:2H++2e-═H2↑ |
分析 A、氢氧燃烧电池是将化学能转化为电能;
B、在原电池中,较活泼的金属往往做负极,负极金属易被腐蚀;
C、钢铁腐蚀的负极反应:Fe-2e-═Fe2+;
D、电解池的阴极发生还原反应.
解答 解:A、氢氧燃烧电池是将化学能转化为电能,是原电池,故A正确;
B、在锌、铁原电池中,较活泼的金属锌往往做负极,负极金属易被腐蚀,正极金属可以被保护,故B正确;
C、钢铁腐蚀的负极反应:Fe-2e-═Fe2+,而不是生成铁离子,故C错误;
D、电解池的阴极发生还原反应,氢离子放电生成氢气,电极反应式为:2H++2e-═H2↑,故D正确;
故选C.
点评 本题考查学生原电池和电解池的工作原理以及应用知识,注意知识的积累是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2═CO2+2H2O | |
| D. | 铅蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=C(CH3)-CH=CH2 2-甲基-1,3-二丁烯 | |
| B. | 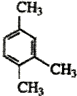 1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2C≡CCH2 CH (CH3)2 6-甲基-3-庚炔 | |
| D. | 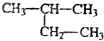 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
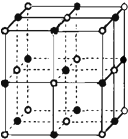 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的分子式为C18H32O2 | |
| B. | 脂肪酸Y能发生取代反应 | |
| C. | Y的结构简式可能为CH3CH=CH(CH2)14COOH | |
| D. | Y的结构简式为CH3(CH2)16COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 0.5mol/L 的AlCl3溶液中含有的Al3+数为0.5 NA | |
| C. | 常温常压下16g O2中,氧原子数为NA | |
| D. | 1mol过氧化钠与水充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
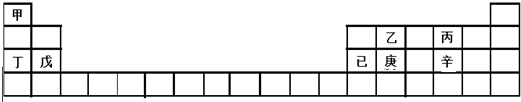
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1混合的Pb3O4、PbO | B. | 1:2混合的PbO2、Pb3O4 | ||
| C. | 1:4:l混合的PbO2、Pb3O4、PbO | D. | 1:1:l 混合的PbO2、Pb3O4、PbO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com