
 Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛.请回答下列问题:
Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛.请回答下列问题:| 1 |
| 8 |
| 1 |
| 2 |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) Zn形成金属晶体,其金属原子堆积属于下列 模式
A.简单立方 B.钾型 C.镁型 D.铜型
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ; 葡萄糖[CH2OH(CHOH)4CHO]分子中手性碳原子有 个。
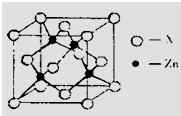
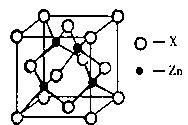
(3)锌与某种元素X通过共价键结合,形成空间网状结构的晶体,下图表示该化合物晶胞,该化合物的化学式为 ;该化合物的晶体熔点远远高于干冰,原因是 。
(4) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,请问两分子AlCl3之间以 方式二聚。
(选择填写:“离子键”“共价键”“金属键”“氢键”)
(5 )超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,A1N晶体与金刚石类似,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间构型为 。在四大晶体类型中,AlN属于 晶体。
(6)与锌同周期,最外层有3个未成对电子数的元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取了 杂化方式,分子的空间构型是 ,属于 分子(选择填写“极性”“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) Zn形成金属晶体,其金属原子堆积属于下列 模式
A.简单立方 B.钾型 C.镁型 D.铜型
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ; 葡萄糖[CH2OH(CHOH)4CHO]分子中手性碳原子有 个。
(3)锌与某种元素X通过共价键结合,形成空间网状结构的晶体,下图表示该化合物晶胞,该化合物的化学式为 ;该化合物的晶体熔点远远高于干冰,原因是 。
(4) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,请问两分子AlCl3之间以 方式二聚。
(选择填写:“离子键”“共价键”“金属键”“氢键”)
(5 )超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,A1N晶体与金刚石类似,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间构型为 。在四大晶体类型中,AlN属于 晶体。
(6)与锌同周期,最外层有3个未成对电子数的元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取了 杂化方式,分子的空间构型是 ,属于 分子(选择填写“极性”“非极性”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com