
【题目】一定条件下,将一定物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
(1)判断:此反应此时_______(填“是”或“否”)达到了平衡状态。
(2)反应开始前容器中的A和B的物质的量之比为n(A):n(B)=_______。
(3)B的平均反应速率v(B)=________mol/(L·min)。
(4)x的值为________。
【答案】是 3:1 0.05 4
【解析】
(1)由于A的转化率达到了最大值,且A和B的转化率相等,此时已经达到了平衡状态,故答案为:是。
将一定物质的量的A、B混合于2L的密闭容器中,经5min后,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5mol/L,则生成的C为0.2mol/(L·min)×2L×5min=2mol,D为0.5mol/L×2L=1mol,
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始(mol) a b 0 0
变化(mol) 1.5 0.5 2 1
5min(mol) 2 1
(2)由于A和B的转化率相等,则![]() ,则反应开始前容器中的A和B的物质的量之比为n(A):n(B)=a:b=3:1,故答案为:3:1。
,则反应开始前容器中的A和B的物质的量之比为n(A):n(B)=a:b=3:1,故答案为:3:1。
(3)由题意可知D的平均反应速率为v(D)=![]() =0.1 mol/(L·min),化学方程式中反应速率之比等于化学计量数之比,所以B的平均反应速率v(B)=1/2v(D)=
=0.1 mol/(L·min),化学方程式中反应速率之比等于化学计量数之比,所以B的平均反应速率v(B)=1/2v(D)=![]() ×0.1 mol/(L·min)=0.05mol/(L·min),故答案为:0.05。
×0.1 mol/(L·min)=0.05mol/(L·min),故答案为:0.05。
(4)根据化学方程式中反应速率之比等于化学计量数之比,v(C):v(D)=0.2mol/(L·min):0.1mol/(L·min)=2:1,则x=4,故答案为:4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面两种气体的分子数一定相等的是( )
A. 氮气和一氧化碳的质量相等,密度不同
B. 氮气和一氧化碳体积相等
C. 在温度相同、体积相等的条件下氧气和氮气
D. 在压强相同、体积相等的条件下氧气和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为( )
A. Ba(OH)2溶液中加入少量NaHCO3溶液:HCO3-+Ba2++OH-=BaCO3![]() +H2O
+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓
C. NH4HCO3稀溶液与过量的KOH溶液反应:HCO3-+OH-=CO32-+H2O
D. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①增大浓度,或加热或加压,或使用催化剂,一定可以加快反应速率.
②气态氢化物的稳定性:H2O>NH3>SiH4
③如图所示实验可证明元素的非金属性:Cl>C>Si
|
④用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
A. ①②B. ②③C. ③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
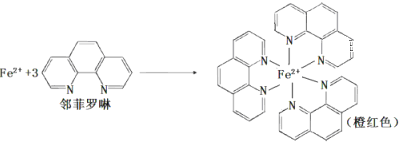
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
FeCl3+2NH2OHHCl= 4FeCl2+N2O↑+6HCl+H2O
① Fe3+在基态时,核外电子排布式_____;
② 羟胺中(NH2OH)采用sp3杂化的原子有______,三种元素电负性由大到小的顺序为______;
③ Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为____;
④N2O分子的空间构型为______(用文字描述)。
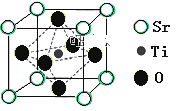
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可产生电流。钛酸锶晶体结构如图所示,则钛酸锶的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中提供的部分短周期元素原子半径及主要化合价的信息,回答下列问题
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.104 | 0.099 | 0.066 |
主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | +7、-1 | -2 |
(1)A在元素周期表中位置是____。
(2)B的离子结构示意图:_____,
(3)C单质与A的最高价氧化物对应的水化物反应的离子方程式:____。
(4)元素最高价氧化物对应的水化物酸性最强的是:____ (写化学式)。
(5)A元素与F元素形成的化合物的电子式 _____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com