
| X | ||||||
| Y | Z | W |
| A. | 工业上电解YW饱和溶液冶炼金属Y | |
| B. | Y、W的最高价氧化物的水化物均能溶解金属Z | |
| C. | 气态氢化物的稳定性:W>X | |
| D. | 简单离子半径的大小顺序:r(Y+)>r(X-) |
分析 Z为地壳中含量最高的金属元素,则Z为Al,由短周期元素X、Y、Z、W在元素周期表中的相对应位置,可知X为F元素、Y为Na、W为Cl.
A.工业上电解熔融氯化钠冶炼钠;
B.铝能与强碱、强酸反应;
C.元素非金属性越强,对应氢化物越稳定;
D.电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:Z为地壳中含量最高的金属元素,则Z为Al,由短周期元素X、Y、Z、W在元素周期表中的相对应位置,可知X为F元素、Y为Na、W为Cl.
A.电解氯化钠溶液得到氢氧化钠、氯气与氢气,工业上电解熔融氯化钠冶炼钠,故A错误;
B.Y、W的最高价氧化物的水化物分别为氢氧化钠、高氯酸,Al能与氢氧化钠、高氯酸反应,故B正确;
均能溶解金属Z
C.非金属性F>Cl,元素非金属性越强,对应氢化物越稳定,故C错误;
D.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(Na+)<r(F-),故D错误,
故选:B.
点评 本题考查结构性质位置关系,明确元素是解题关键,掌握微粒半径比较,熟悉中学常见化学工业.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

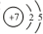 ,其单质的电子式为
,其单质的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由碳燃烧生成CO的热化学方程式是C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=(Q1-0.5Q2)kJ/mol | |
| B. | 由碳燃烧生成1mol CO放出的热量是(Q1-0.5Q2)kJ | |
| C. | 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol | |
| D. | 碳和CO2反应的热化学方程式是C(s)+CO2(g)═2CO(g)△H=(2Q2-2Q1)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体可能是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烷 | D. | 混合气体可能是乙烯和乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
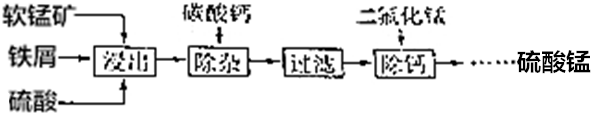
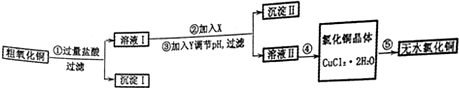
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com