
| A. | 金 | B. | 铁 | C. | 锰 | D. | 炭 |
科目:高中化学 来源: 题型:解答题
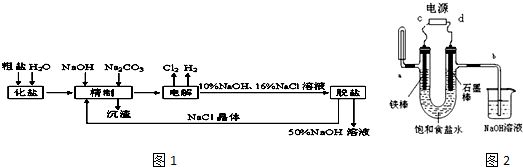
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C-CH2CH3 丁炔 | B. | CH2═CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 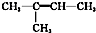 2-甲基丁烯 2-甲基丁烯 | D. | 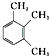 1,2,3-三甲苯 1,2,3-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
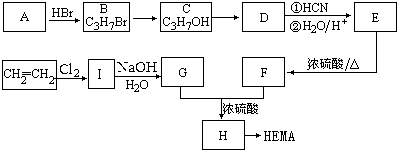
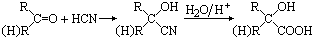
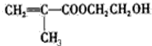 甲基丙烯酸羟乙酯
甲基丙烯酸羟乙酯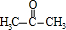 +2H2O.
+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | mol/L•s | B. | mol•(L•min)-1 | C. | mol/(L•min) | D. | mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
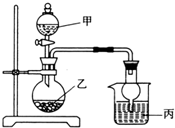 用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( )
用如图所示装置进行实验(必要时可以进行加热),如表实验现象描述错误的是( ) | 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | H2O2 | MnO2 | FeCl2溶液 | 溶液由浅绿色变为棕黄色 |
| B | 浓氨水 | CaO | AgNO3溶液 | 有白色沉淀生成 |
| C | H2SO4 | Na2SO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓HNO3 | Cu | NaHCO3溶液 | 有无色气体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯的最高价为+7价而硫的最高价为+6价 | |
| B. | HCl的酸性比H2S的酸性强 | |
| C. | H2S能被Cl2氧化成硫单质 | |
| D. | HClO的氧化性比H2SO4的氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
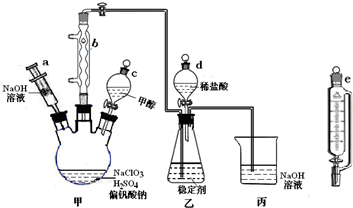
| 时间 稳定剂 | 0天 | 2天 | 4天 | 6天 | 8天 | 10天 | 12天 | 14天 | 16天 |
| 稳定剂1浓度 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
| 稳定剂2浓度 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com