
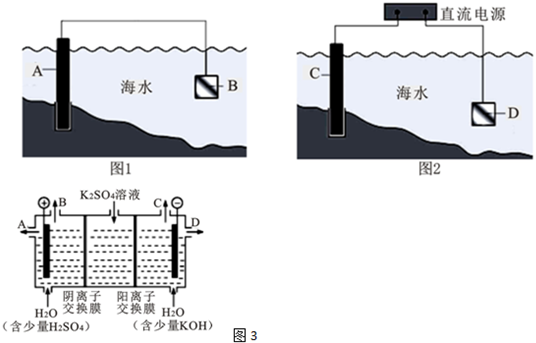
分析 (1)形成原电池时,Fe作正极被保护;该电化学保护方法的名称是 牺牲阳极的阴极保护法;
(2)Fe作阴极被保护,则钢闸门C做阴极;离子总反应式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)A、电解过程中阳离子向阴极移动;
B、A电极为阳极,从A极处逸出的气体是氯气;
C、恢复到电解前电解质的浓度,”出什么加什么“的原则分析;
(4)①该电解槽的阳极反应方程式为氢氧根离子放电,生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑; 阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
②氢氧化钾是阴极产生,所以制得的氢氧化钾溶液从出口 D导出;
③负极发生氧化反应,则该电池的负极电极方程式为 CH4-8e-+10OH-=CO32-+7H2O,B极产生氧气,在标准状况下22.4L气体,物质的量为:1mol,转移电子数为4mol,根据得失电子守恒,理论上需要通入0.5 mol CH4;
④电解过程中阴极区是氢离子放电生成氢气,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的碱性明显增强.
解答 解:(1)形成原电池时,Fe作正极被保护,则要选择活泼性比Fe强的金属作负极,所以选锌; 该电化学保护方法的名称是牺牲阳极的阴极保护法;
故答案为:b;牺牲阳极的阴极保护法;
(2)Fe作阴极被保护,则钢闸门C做阴极;离子总反应式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;故答案为:阴; 2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)A、电解过程中阳离子向阴极移动,B为阴极,溶液中Na+向,B极移动,故A错误;
B、A生成氯气,能使湿润KI淀粉试纸变蓝,故B正确;
C、反应一段时间后加适量HCl气体,可恢复到电解前电解质的浓度,不是加入盐酸,故C错误;
故答案为:B;
(4)①该电解槽的阳极反应方程式为氢氧根离子放电,生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑; 阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;小于;
②氢氧化钾是阴极产生,所以制得的氢氧化钾溶液从出口 D导出,故选D;
③负极发生氧化反应,则该电池的负极电极方程式为 CH4-8e-+10OH-=CO32-+7H2O,B极产生氧气,在标准状况下22.4L气体,物质的量为:1mol,转移电子数为4mol,根据得失电子守恒,理论上需要通入0.5 mol CH4,故答案为:CH4-8e-+10OH-=CO32-+7H2O;0.5;
④电解过程中阴极区是氢离子放电生成氢气,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的碱性明显增强,故答案为:H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+),所以阴极区碱性明显增强.
点评 本题考查了原电池和电解池原理,难度不大,注意燃料原电池电极反应式的书写时,要根据电解质溶液的酸碱性确定生成的离子或物质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤③①④② | B. | ⑤③①②④ | C. | ②④①③⑤ | D. | ②④③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 氮气的电子式: | ||
| C. | Cl-离子的结构示意图: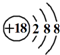 | D. | NaCl的电子式: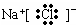 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙 |
| A | 电解质 | BaSO4、NaHSO4、SO3 |
| B | 弱电解质的电离 | 均分步电离 |
| C | 化学平衡影响因素 | 温度、压强、浓度、催化剂等 |
| D | 化学电源 | 一次电池、二次电池、燃料电池等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
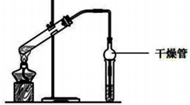 (1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.
(1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com