
��12�֣�������ԭ��Ӧ�������������о��й㷺����;���ᴩ�Ž�
��1�����������������е������з�����������ԭ��Ӧ����
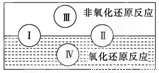
��2��ˮ���������Ҫ��ɲ��֣��������к�������һ�����ʡ��������ֻ�����Ӧ������������ԭ��Ӧ�Ĺ�ϵ��Ҳ������ͼ���
��д����ˮ�μӵķ��Ϸ�Ӧ���͢���һ����ѧ����ʽ��
����ˮΪ________����
��3����ϸ��ұ��������ijЩϸ���������л���ܿ��ɽ�����ʯ��������Һ������������˾������ÿ����е���������������Ҫ�ɷ�FeS2������ΪFe2��SO4��3����ʹ��Һ������ǿ��
�ٸù��̷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
�����ǿ�����Fe2��SO4��3��ǿ�������ܽ�ͭ��ʯ��Cu2S����Ȼ�������м��һ���õ�ͭ���ù����з��������ӷ�Ӧ����ʽ���£��벹����������ƽ��
________Cu2S��________Fe3����______H2O________Cu2����________Fe2����________����������________SO42-��
��4���ǰ���NH2OH����һ�ֻ�ԭ������25��00 mL 0��049 mol/L�ǰ���������Һ����������������Һ����������·�Ӧ�����ɵ�Fe2+����ǡ����24��5 mL 0��020 mol/L��KMnO4������Һ��Ӧ������������Ӧ�У��ǰ������������� ��
��1��D ��2��C+H2O(g) CO+H2��2�֣�
�������������ɣ�
CO+H2��2�֣�
�������������ɣ�
��3����4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4��2�֣�
2Fe2(SO4)3+2H2SO4��2�֣�
��1 10 4 2 10 8 H+��2�֣�
��4��N2O��2�֣�
����������1��ABC���������仯��ȼ����������ԭ��Ӧ����ѡD��
��2�������û���Ӧ�����Է���ʽ������C+H2O(g) CO+H2���ڸ÷�Ӧ��ˮ����������
CO+H2���ڸ÷�Ӧ��ˮ����������
��3������Һ������ǿ��˵����Ӧ�л��������ᣬ���Է���ʽΪ4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4��
2Fe2(SO4)3+2H2SO4��
�ڸ���ԭ���غ��֪����һ���������������ӡ�1molCu2Sʧȥ10mol���ӣ�������Ҫ������Fe3����10mol��Ȼ��۲취���������ġ�
��4�����ǰ������������е�Ԫ�صĻ��ϼ���n������ݵ��ӵĵ�ʧ�غ��֪��25��0.049����n��1����24.5��0.020����7��2�������n��1����������������N2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ʴ | B����ˮɹ�� | C��ʳ�︯�� | D��ȼ�ű��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com