
分析 A.溴苯中常混有溴,溴在溴苯中的溶解度比在水中的大;
B.实验室制取乙烯时测的是液体的温度;
C.溴和三溴苯酚都溶于苯中;
D.是向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液;
E.除杂不能引入新的杂质;
F.溴乙烷水解后显碱性,检验溴离子在酸性条件下.
解答 解:A.溴苯中常混有溴,溴在溴苯中的溶解度比在水中的大,应加入氢氧化钠,然后分液,故A错误;
B.实验室制取乙烯时测的是液体的温度,所以必须将温度计的水银球插入反应液中,以控制反应液的温度,故B正确;
C.三溴苯酚不溶于水,但可溶于液苯,且过量的溴也溶于苯中,故C错误;
D.银氨溶液的配制是向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液,故D正确;
E.如果加入乙醇和浓硫酸,虽然可以反应掉部分乙酸,但是又会引入乙醇,而且加热会使它挥发,最好不用,一般加入少量碳酸钠即可,故E错误;
F.将10滴溴乙烷加入到1mL 10%的烧碱溶液中,加热后,发生水解反应生成溴离子,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子,故F错误.
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯及有机物制备实验,侧重有机物性质及实验操作的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2 SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
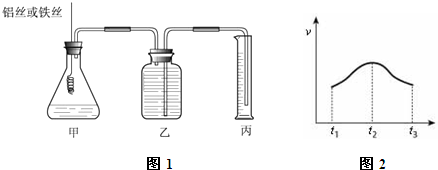
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
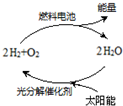 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池放电时,电池中CO32-的物质的量将逐渐减少 | |
| D. | 电路中电子由负极、经熔融的K2CO3流到正极,形成闭合回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
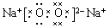 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com