
分析 (1)电子最后填充3p能级,元素处于p区,为主族元素,元素周期数=电子层数、主族族序数=最外层电子数;
(2)电子最后填充5p能级,元素处于p区,为主族元素,主族元素周期数=电子层数、主族族序数=最外层电子数;
(3)电子最后填充3d能级,元素处于d区,为副族元素,元素周期数=电子层数、族序数=外围电子数;
(4)外围电子数为11,处于第11列,处于IB族,为副族元素,元素周期数=电子层数.
解答 解:(1)核外电子排布为1s22s22p63s23p5,电子最后填充3p能级,元素处于p区,为主族元素,电子层数为3、最外层电子数为7,处于周期表中第三周期 VIIA族,故答案为:第三周期 VIIA族;
(2)核外电子排布为[Kr]4d105s25p2,电子最后填充5p能级,元素处于p区,为主族元素,电子层数为5、最外层电子数为4,处于周期表中第五周期 IVA族,故答案为:第五周期 IVA族;
(3)核外电子排布为[Ar]3d34s2,电子最后填充3d能级,元素处于d区,为副族元素,电子层数为4、外围电子数为5,处于周期表中第五周期 IVA族,故答案为:第五周期 IVA族;
(4)核外电子排布为[Ar]3d104s1,外围电子数为11,处于第11列,即处于IB族,为副族元素,电子层数为4,处于周期表中第四周期 IB族,故答案为:第四周期 IB族.
点评 本题考查结构与位置关系,难度不大,理解掌握根据外围电子排布判断再周期表中的位置.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 28 | B. | 36 | C. | 64 | D. | 48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
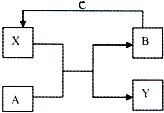 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )| A. | 若X是光导纤维的主要成分,工业上常利用反应I制备B,Y的化学式为CO | |
| B. | 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若组成A的元素在短周期中原子半径最大(稀有气体除外),以Y为电解质溶液,气体B为燃料,C为氧化剂可构成燃料电池,工作一段时间后,Y溶液的pH增大 | |
| D. | 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,Y的电子式为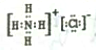 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照甲烷与氯气的混合物;乙烯使酸性高锰酸 钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴人浓硝酸和浓硫酸的混合液中水浴加热; 乙烯与水蒸气在一定条件下反应生成乙醇 | |
| D. | 在苯中滴人溴水,溴水褪色;乙烯使溴水褪色. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸显深蓝色的溶液中,Cu2+、NO3-、Fe3+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- | |
| D. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com