
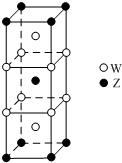
 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多. .
.分析 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,则T、X、Y分别为C、O、Mg元素,元素Z的价电子数等于能层数,则Z为Al元素;
元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多,为Cr元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族,元素第一电离能随着原子序数增大而减弱;
(2)C、O分别与氢组成的C2H2与H2O2分子中,乙炔中每个C原子价层电子对个数是2且不含孤电子对,每个双氧水分子中每个O原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论判断T、X原子轨道的杂化类型;
(3)①CO32-中C原子价层电子对个数=3+$\frac{4+2-3×2}{2}$=3且不含孤电子对,根据价层电子对互称理论判断其空间构型;
②N3-离子与CO2分子互为等电子体,根据二氧化碳电子式书写N3-的电子式;
(4)Al2O3的熔点比MgO高,二者都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比;
(5)①W为Cr元素,其原子核外有24个电子,根据构造原理书写元素Cr基态原子的核外电子排布式;
②利用均摊法计算该合金中W与Z的原子个数比.
解答 解:短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,则T、X、Y分别为C、O、Mg元素,元素Z的价电子数等于能层数,则Z为Al元素;
元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多,为Cr元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族,元素第一电离能随着原子序数增大而减弱,所以第一电离能大小顺序是O>Mg>Al,
故答案为:O>Mg>Al;
(2)C、O分别与氢组成的C2H2与H2O2分子中,乙炔中每个C原子价层电子对个数是2且不含孤电子对,每个双氧水分子中每个O原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论判断T、X原子轨道的杂化类型分别为sp、sp3,故答案为:sp;sp3;
(3)①CO32-中C原子价层电子对个数=3+$\frac{4+2-3×2}{2}$=3且不含孤电子对,根据价层电子对互称理论判断其空间构型为平面三角形,故答案为:平面三角形;
②N3-离子与CO2分子互为等电子体,根据二氧化碳电子式书写N3-的电子式为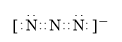 ,
,
故答案为: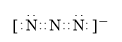 ;
;
(4)Al2O3的熔点比MgO高,二者都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,该同学推测的理由是:两者均为离子晶体,由于Al3+带的电荷高于Mg2+,且半径小于Mg2+,所以Al2O3的晶格能大,
故答案为:两者均为离子晶体,由于Al3+带的电荷高于Mg2+,且半径小于Mg2+,所以Al2O3的晶格能大;
(5)①W为Cr元素,其原子核外有24个电子,根据构造原理书写元素Cr基态原子的核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,
故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
②该晶胞中Al原子个数=1+8×$\frac{1}{8}$=2,Cr原子个数=2+8×$\frac{1}{4}$=4,所以Cr、Al原子个数之比=4:2=2:1,故答案为:2:1.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生计算、空间现象及基本理论的应用能力,涉及晶胞计算、原子核外电子排布、微粒空间构型判断、原子杂化等知识点,综合性较强,需要学生熟练掌握基础知识并能灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 | |
| B. | H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解 | |
| C. | 氯与钠形成离子键,氯与硅形成共价键 | |
| D. | “NO2球”在冷水中颜色变浅,在热水中颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
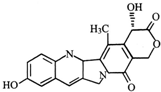
| A. | 该物质属于芳香烃 | |
| B. | 该物质能与NaHCO3反应 | |
| C. | 该物质中存在三个苯环 | |
| D. | 一定条件下,1mol该物质最多可与2mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为
A.X3Y B.XY3 C.XY2 D.X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g) 不能自发进行,则该反应的△H>0 | |
| B. | 25℃时,向0.1 mol•L-1CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | Ba的金属活动性强于Mg,可以通过电解BaCl2溶液的方法获得金属钡 | |
| D. | 对硫酸工业中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发氢能替代化石燃料 | |
| B. | 工业含氮废水经处理达标后排放 | |
| C. | 农作物秸秆等露天焚烧制肥料 | |
| D. | 金属、塑料、玻璃、纸类等制品应分类回收处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 向Cu粉中加入过量的浓HNO3:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氯化铵溶液显酸性的原因:NH4++OH-=NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
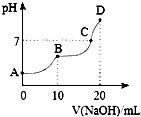 25℃时,向10mL 0.1mol•L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是( )
25℃时,向10mL 0.1mol•L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是( )| A. | C点溶液中含有NaHC2O4和Na2C2O4 | |
| B. | NaHC2O4溶液中水的电离程度比Na2C2O4溶液中小 | |
| C. | B点,c (Na+)=2[c (H2C2O4)+c (HC2O4-)+c (C2O42-)] | |
| D. | D点,c (Na+)>c (C2O42-)>c (OH-)>c (HC2O4-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列关于离子的检验及结论一定正确的是
A.加入稀盐酸有气体生成,将气体通入澄清石灰水中溶液变浑浊,则溶液中一定有CO32-
B.加入BaCl2溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定有SO42-
C.加入浓氢氧化钠溶液并加热,生成的气体能使湿润的红色石蕊试纸变蓝,则溶液中一定含有NH4+
D.加入碳酸钠溶液生成白色沉淀,再加盐酸白色沉淀消失,则溶液中一定含有Ba2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com