
| A����Ӧ��ʼ��2����ʱ����BŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/��L?min�� |
| B����Ӧ��ʼ��2����ʱ��A��ת����Ϊ10% |
| C���������������䣬�����¶ȣ�A���������������÷�Ӧ�ġ�H��0 |
D���������������䣬����ѹǿ����ѧ��Ӧ���ʵı仯�����Ҳ�ʾ��ͼ |
| ||
| ��t |
| 3 |
| 2 |
| ||
| 2min |
| 1 |
| 2 |
| 0.1mol |
| 1mol |


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һԪ����H3BO3��ˮ��Һ�е���H3BO3+H2O?H2BO3-+H3O+ |
| B��Fe��NO3��2��Һ�еμ�ϡ����Fe+4H++NO3-=Fe3++NO��+2H2O |
| C����������Һ��ͨ��CO2��C6H5-ONa+CO2+H2O��C6H5-OH+Na2CO3 |
| D��������������Be��OH��2����NaOH��ҺBe��OH��2+OH-=BeO22-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
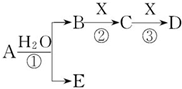 A��B��C��D��E�Ƕ�����Ԫ����ɵ���ѧ���������ʣ����ǵ�ת����ϵ��ͼ��ʾ�����ֲ���ͷ�Ӧ������ȥ����
A��B��C��D��E�Ƕ�����Ԫ����ɵ���ѧ���������ʣ����ǵ�ת����ϵ��ͼ��ʾ�����ֲ���ͷ�Ӧ������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ӧʱ��/min | n��CO��/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A����Ӧ��t1 min�ڵ�ƽ������Ϊv(H2)=
| ||
| B�����������������䣬��ʼʱ�������г���0.60molCO��1.20molH2O������ƽ��ʱ��n��CO2��=0.40mol | ||
| C�����������������䣬��ƽ����ϵ����ͨ��0.20molH2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O������������� | ||
| D���¶�����800��ʱ����������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��50% | B��33.3% |
| C��25% | D��20% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
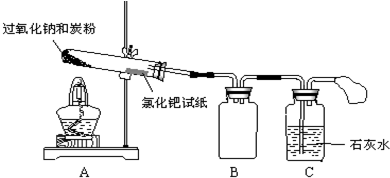
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com