
| A、将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C、氯化铁溶液与铁反应:2Fe3++Fe=3Fe2+ |
| D、碳酸钙中滴加盐酸:CO32-+2H+=CO2↑+H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在外电路中电子由正极流向负极 |
| B、在原电池中,只有金属锌作为负极 |
| C、原电池工作时,阳离子向正极方向移动 |
| D、原电池工作时,阳离子向负极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8g | B、4.4g |
| C、10.6g | D、1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ | ||||
| B、NO2与水的反应:3NO2+H2O=2NO3-+2H++NO | ||||
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
D、用铂电极电解氯化镁溶液:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与硫酸亚铁反应 Cu+Fe2+═Cu2++Fe |
| B、澄清的石灰水跟盐酸反应 H++OH-═H2O |
| C、碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| B | D | C | B | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| n(B) |
| n(D) |
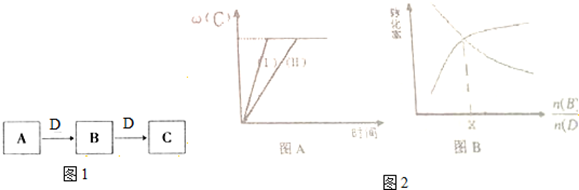
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
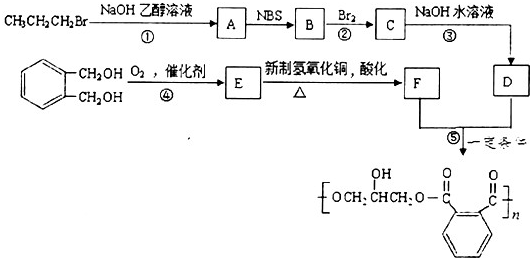
| NBS |
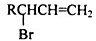
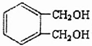 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com