
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验 | 产生气泡,木条复燃 |
分析 Ⅰ、(1)将10.00mL密度为ρ g/mL的过氧化氢溶液稀释至250mL选用250ml容量瓶;量取稀释后的过氧化氢溶液25.00mL至锥形瓶中选用滴定管或移液管;
(2)双氧水遇到强氧化剂高锰酸钾时表现强的还原性,对应氧化产物是氧气,高锰酸钾的还原产物是二价锰离子;
(3)高锰酸钾本身是一种紫红色的液体,当达到滴定终点时,可以通过自身颜色来判断;
(4)根据高锰酸钾和双氧水反应的方程式来计算;
(5)滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则气泡的体积计入了标准液的量中去.
Ⅱ、过氧化氢具有氧化性,能将碘化钾氧化为单质碘;过氧化氢具有不稳定性,加热会生成水和氧气,氧气能使木条复燃.
解答 解:Ⅰ、(1)将10.00mL密度为ρ g/mL的过氧化氢溶液稀释至250mL选用250ml容量瓶;量取稀释后的过氧化氢溶液25.00mL至锥形瓶中选用滴定管或移液管,故答案为:250ml容量瓶,滴定管或移液管;
(2)双氧水遇到强氧化剂高锰酸钾时表现强的还原性,反应的实质是:2MnO4-+5H2O2+6H+=2Mn2++8H2O+502 ,故答案为:2;5;6;2;8;502 ;
(3)高锰酸钾本身是一种紫红色的液体,高锰酸钾标准溶液注入滴定管中滴定双氧水时,当达到滴定终点时,溶液呈紫红色,且30秒内不褪,故答案为:滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色;
(4)根据高锰酸钾和双氧水反应的方程式,设双氧水的物质的量为n,则
2MnO4-+5H2O2+6H+=2Mn2++8H2O+502
2 5
cV×10-3mol n
则$\frac{2}{cV×10{\;}^{-3}mol}$=$\frac{5}{n}$
解得n=2.5cV×10-3mol
所以25.00mL双氧水的质量=2.5cV×10-3mol×34g/mol=0.085cVg,250.00mL双氧水的质量=0.85cVg,则双氧水的质量分数为:$\frac{0.85cVg}{10ρg}$×100%=$\frac{0.085cV}{ρ}$,故答案为:$\frac{0.085cV}{ρ}$;
(5)滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则气泡的体积计入了标准液的量中去,相当于使用的标准液偏多,所以结果偏高,故答案为:偏高.
Ⅱ、过氧化氢具有氧化性,能将碘化钾氧化为单质碘,要探究其氧化性,可以让它和碘化钾反应,具体操作是:取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液,能将碘离子氧化为单质碘,碘单质遇淀粉变蓝色;过氧化氢具有不稳定性,加热会生成水和氧气,氧气能使木条复燃,故答案为:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 探究氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验 | 产生气泡,木条复燃 |
点评 本题是一道实验探究题,要求学生具有分析和解决问题的能力,综合性较强,难度很大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 图标 | 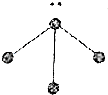 | 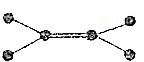 | 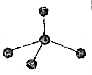 |  |
| 化学式 | NH3 | C2H4 | CCl4 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
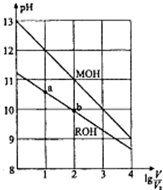 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,| A. | MOH的碱性弱于ROH的碱性 | |
| B. | ROH的电离平衡常数:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)不相等 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
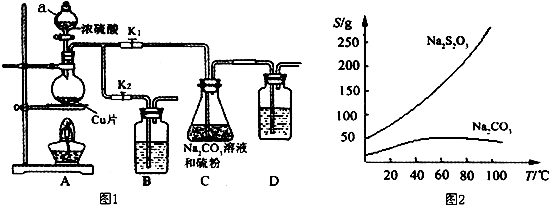
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

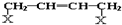
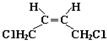

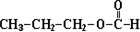 和
和 

 _
_查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加入足量的盐酸 CO32-+2H+═CO2↑+H2O | |
| B. | 单质铁和三氯化铁溶液反应生成氯化亚铁 Fe+Fe3+═2Fe2+ | |
| C. | 金属钠与水反应生成氢氧化钠和氢气Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铵晶体和石灰粉共热产生氨气 NH4++OH-═NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
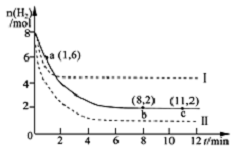 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2mol•L-1•min-1 | |
| B. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| C. | 曲线II对应的条件改变是降低压强 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<8/3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收其中的石墨电极 | |
| B. | 回收利用电池外壳的金属材料 | |
| C. | 不使电池中渗露的电解液腐蚀其他物品 | |
| D. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com