
【题目】海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如下图所示:

(1)写出镁原子的结构示意图:_________________。在反应①→⑤中属于氧化还原反应的是___________(填序号);
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、________溶液;③_________;④滤液中加适量盐酸;⑤__________(请补全缺少的实验步骤或试剂);
(3)某同学利用反应①原理制备氯气,将200 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为__________L;
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L―1稀盐酸100 mL,需要用量筒量取浓盐酸________mL,接下来的配制过程除了玻璃棒和烧杯外,还需要用到的玻璃仪器有___________________。
【答案】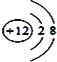 ①⑤ Na2CO3 过滤 蒸发结晶 11.2 4.4 胶头滴管、100mL容量瓶
①⑤ Na2CO3 过滤 蒸发结晶 11.2 4.4 胶头滴管、100mL容量瓶
【解析】
(1)镁离子质子数为12,核外电子数为10,有2个电子层,各层电子数为2、8;有元素化合价发生变化的反应属于氧化还原反应,结合具体反应判断;
(2)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,据此判断;
(3)根据n=cV计算NaCl的物质的量,结合方程式计算生成氯气的体积;
(4)根据稀释过程中溶质的物质的量不变计算,结合物质的量浓度溶液的配制原理和步骤判断需要的仪器。
(1)镁离子质子数为12,核外电子数为10,有2个电子层,各层电子数为2、8,镁离子结构示意图为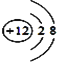 ;反应①是电解食盐水生成氢氧化钠、氯气与氢气,属于氧化还原反应,反应②是溶液中镁离子与石灰乳反应生成氢氧化镁沉淀,属于非氧化还原反应,反应③是氢氧化镁与盐酸反应,属于非氧化还原反应,反应④是氯化镁晶体失去结晶水得到氯化镁,属于非氧化还原反应,反应⑤是分解熔融氯化镁生成镁与氯气,属于氧化还原反应,故答案为①⑤;
;反应①是电解食盐水生成氢氧化钠、氯气与氢气,属于氧化还原反应,反应②是溶液中镁离子与石灰乳反应生成氢氧化镁沉淀,属于非氧化还原反应,反应③是氢氧化镁与盐酸反应,属于非氧化还原反应,反应④是氯化镁晶体失去结晶水得到氯化镁,属于非氧化还原反应,反应⑤是分解熔融氯化镁生成镁与氯气,属于氧化还原反应,故答案为①⑤;
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后过滤,向滤液加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③过滤;④滤液中加适量盐酸;⑤蒸发结晶;
(3)200mL 5molL-1NaCl溶液中NaCl的物质的量=0.2L×5mol/L=1mol,由2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑可知生成氯气为1mol×1/2=0.5mol,标况下,生成氯气的体积=0.5mol×22.4L/mol=11.2L;
2NaOH+Cl2↑+H2↑可知生成氯气为1mol×1/2=0.5mol,标况下,生成氯气的体积=0.5mol×22.4L/mol=11.2L;
(4)由于稀释过程中溶质的物质的量不变,则需要用量筒量取浓盐酸的体积为100mL×0.5 mol·L-1/11.3 mol·L-1≈4.4mL;用浓盐酸配制稀盐酸的一般步骤分别是计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器除了量筒、玻璃棒和烧杯外,还需要用到的玻璃仪器有胶头滴管、100mL容量瓶。


科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A. 氯水、水玻璃、明矾都是混合物
B. CO2、NO2、P2O5均为酸性氧化物
C. 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
D. 根据分散系粒子直径的大小将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝的叙述中,不正确的是( )
A.铝是地壳里含量最多的金属元素B.铝是一种比较活泼的金属
C.在常温下,铝不能与氧气反应D.在化学反应中,铝易失去电子,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是化工行业广泛应用的基础原料,某化学兴趣小组为探究浓硫酸所具有的一些特殊性质,进行如下有关实验。
实验一:浓硫酸与铜反应
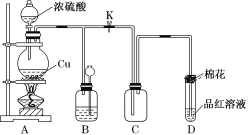
(1)装置A中发生反应的化学方程式为___________________________________;
当反应转移0.2mol电子时,生成气体在标况下的体积为____L,被还原的硫酸为____mol
(2)装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是_________________;
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是________________,B中应放置的溶液是________。
A.水 B.酸性KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
实验二:浓硫酸与碳反应,并验证反应生成的气体产物
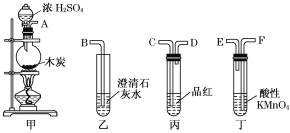
(4)冯同学认为按照甲、丙、丁、乙的装置顺序,即可验证产物为SO2和CO2,那么丁中酸性KMnO4溶液的作用是______________;
(5)陈同学认为丙装置要使用两次才能确保检验气体产物的准确性,如按该同学所说,气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A——________________________________________________________——B;
能说明气体产物中有CO2的实验现象是①__________________②____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明的某强酸性溶液中能大量共存的离子组是
A.Na+、Mg2+、Cl-、OH-B.Ca2+、K+、Cl-、NO3-
C.Cu2+、K+、SO42-、NO3-D.Na+、HCO3-、OH-、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com