
| A、Be2+中的电子数和质子数之比一定为1:2 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
D、Cl-的结构示意图为: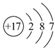 |
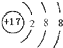 ,故D错误;
,故D错误;

科目:高中化学 来源: 题型:
| A、Na+、HCO3-、Cl- |
| B、Cu2+、Na+、SO42- |
| C、K+、SO42-、OH- |
| D、Fe2+、Al3+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2L | B、5.6L |
| C、4.48L | D、2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液中c(D+)=c(OD-)=4×10-8mol/L |
| B、保持温度不变,向重水中通入一定量的HCl气体,D2O电离程度减小 |
| C、溶解0.01molDCl得到1LD2O溶液,其pD=2 |
| D、在100mL0.2mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液(忽略混合后体积变化),混合后溶液pD=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )| A、洗气或干燥装置:瓶内放一定体积溶液,由a管口进气 |
| B、用于收集不溶于水的气体:瓶内充满水,由b管口进气 |
| C、提供少量CO:瓶内充满CO,b管口接自来水龙头 |
| D、H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、④⑤ |
| C、④⑤⑦ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
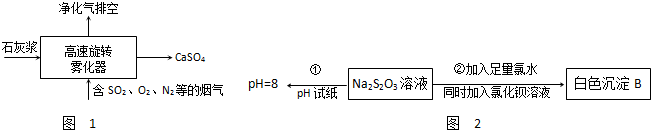
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | Ka1 | Ka2 |
| H2C2O4 | 5.9×10-2 | 6.4×10-5 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2SO3 | 1.3×10-2 | 5.6×10-8 |
| HClO | 4.7×10-10 | |
| CH3COOH | 1.6×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com