
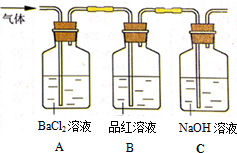
 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑
工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑分析 (1)绿矾样品被氧化会生成Fe3+,Fe3+可使KSCN溶液会变血红色,据此答题;
(2)①SO3溶于水生成硫酸,与氯化钡溶液能生成硫酸钡白色沉淀;
②二氧化硫有毒,会污染空气,所以要用氢氧化钠溶液吸收尾气.
解答 解:(1)绿矾样品被氧化会生成Fe3+,Fe3+可使KSCN溶液会变血红色,所以检验溶液中是否有Fe3+,可以用KSCN溶液,故选C,加入KSCN溶液后可观察的现象为溶液呈血红色,
故答案为:C; 溶液显血红色;
(2)①SO3溶于水生成硫酸,与氯化钡溶液能生成硫酸钡白色沉淀,所以若在装置A中,观察到有白色沉淀生成,则该沉淀为BaSO4,表明有SO3气体存在,
故答案为:BaSO4;SO3;
②二氧化硫有毒,会污染空气,所以氢氧化钠溶液用于吸收多余的SO2,防止造成空气污染,
故答案为:除去多余的SO2,防止污染空气.
点评 本题考查了重要离子和常见化合物的检验,内容较为简单,掌握物质的性质及检测原理是解题的关键,侧重基础知识的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓正确 | |
| B. | 向碳酸镁中加入稀盐酸:CO32-+2H+═CO2↑+H2O 错误,碳酸镁不应该写成离子形式 | |
| C. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓正确 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O 错误,反应物和产物的配比不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①④ | B. | ②③①④ | C. | ③①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
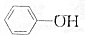 ,③
,③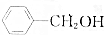 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )| A. | 3类 | B. | 4类 | C. | 5类 | D. | 6类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1molHCl气体时放出|△H1|热量 | |
| D. | 1molHBr(g)具有的能量小于1molHBr(l)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2的摩尔质量与NA个Cl2分子的质量在数值上相同 | |
| B. | 活泼金属从盐酸中置换出1mol H2,转移电子数为NA | |
| C. | 500mL 0.5mol•L-1Al2(SO4)3溶液中,含Al3+数目为0.5NA | |
| D. | 常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com