
 氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题: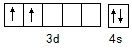 ,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.
,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.分析 (1)基态磷原子核电子排布式为1s22s22p62s23p3,同一能级上的电子能量相同;
(2)元素的非金属性越强,电负性越大,相同结构的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高,如果分子间有氢键的,其沸点更高;
(3)根据价层电子对互斥理论判断NO3-的空间构型及杂化方式;原子个数相等价电子数相等的微粒是等电子体;
(4)Ti的核电荷数为22,根据基态Ti原子的电子排布式书写价电子排布图;根据配合物的结构特点来分析其中的化学键,配位数:中心原子周围的配位原子个数;
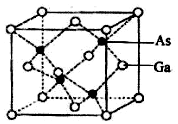
(5)根据晶胞的均摊原理计算晶胞中含有的As、Ga原子数,确定晶胞的化学式,根据晶胞的质量与体积、再结合晶胞的密度公式计算.
解答 解:(1)磷原子核外有5个不同的能级,即有5种不同能量的电子,故答案为:5;
(2)N、P、As非金属性强弱顺序为N>P>As,则N、P、As电负性由大到小的顺序为N>P>As;NH3、PH3、AsH3中沸点最高的是NH3,因为NH3分子间形成氢键;故答案为:N>P>As;NH3;NH3分子间形成氢键;
(3)NO3-中N原子价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,为sp2杂化,所以是平面三角形结构,与NO3-互为等电子体的有:CO32-(SO3、BF3等),故答案为:平面正三角形;sp2;CO32-(SO3、BF3等);
(4)基态Ti原子的电子排布式为Is22s22p63S23p63d24s2(或[Ar]3d24s2),则原子核外价电子排布图为 ;配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,
;配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,
故答案为: ;极性共价键、配位键;6;
;极性共价键、配位键;6;
(5)由晶胞结构可知与晶胞顶点Ga等距离且最近的Ga为晶胞表面中心Ga,则晶胞中距离Ga原子等距且最近的Ga原子有12个,Ga与周围等距且最近的As的原子个数为4,形成的空间构型为正四面体;晶胞中含有Ga的原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,As的原子个数为4,则晶胞的质量为$\frac{4×145}{{N}_{A}}g$,晶胞的体积为(a×10-10)3cm3,则晶胞的密度ρg•cm-3=$\frac{4×145}{{N}_{A}}g$÷(a×10-10)3cm3,则NA=$\frac{4×145}{ρ{a}^{3}×1{0}^{-30}}$;
故答案为:12;正四面体;$\frac{4×145}{ρ{a}^{3}×1{0}^{-30}}$.
点评 本题为物质结构与性质的综合考查,涉及核外电子的排布、分子间作用力、分子的结构与杂化类型、晶胞的计算等,中等难度.


科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
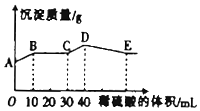 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A. | AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E点对应横坐标稀硫酸的体积为70mL | |
| C. | D点表示的沉淀的化学式为Al(OH)3、BaSO4 | |
| D. | E点沉淀比A点沉淀质量大2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有机物A的结构简式为
有机物A的结构简式为 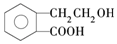 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.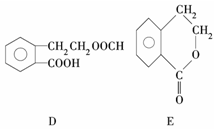
 .
. .
. +2NaOH→
+2NaOH→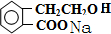 +HCOONa+H2O.
+HCOONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
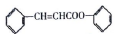 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示: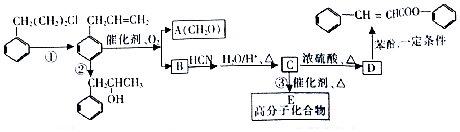
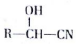 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$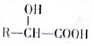
 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +nH2O.
+nH2O. (任写一种).
(任写一种).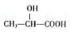 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹(At)是第VIIA族元素,其氢化物的穆定性大于HCl | |
| B. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3水解的产物是HClO和PH3 | ||
| C. | CaC2水解的产物是Ca(OH)2和C2H2 | D. | Al2S3水解的产物是Al(OH)3和H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 将过量氨水加入AlCl3溶液中:Al3++4OH-═AlO2-+2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向NaHCO3溶液中加入等物质的量的Ca(OH)2:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com