
【题目】将一定质量的镁铝合金投入100ml一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位:mL,纵坐标质量单位:g)求:

(1)合金中镁的质量
(2)所用盐酸的浓度。
【答案】(1)4.8g;(2)8mol/L。
【解析】
试题分析:(1)由图可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2 和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3] + 2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol。从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为m(Mg)=0.2mol×24g/mol=4.8g;(2)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L= 0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为c(HCl)=n÷V=0.8mol÷0.1L=8mol/L。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤见下图。
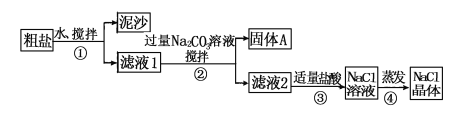
请回答:
(1)步骤①和②的操作名称是________________。
(2)步骤③判断加入盐酸“适量”的方法是________________________。
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止______________,当蒸发皿中有较多量固体出现时,应________________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 猜想Ⅰ成立 | |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,______________ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对H2在O2中燃烧的反应,下列说法不正确的是 ( )
A.该反应为吸热反应
B.该反应为放热反应
C.断裂H—H键吸收能量
D.生成H—O键放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的硫酸根离子的物质的量是___________。
(3)相同质量的SO2、SO3的物质的量之比为__________;氧原子的个数之比为_____________。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是_________;ACl2的化学式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液 ⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液
A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当水发生如下变化时:H2O(s)→H2O(l) →H2O(g),此过程的△S(熵变)判断正确的是 ( )
A.<0
B.>0
C.不变
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工农业生产和生活中常常进行分离或提纯,请选择相应的方法代号填入空白处:
a.过滤 B.蒸馏 C..萃取 d分液
①分离水和菜籽油的混合物 。②海水淡化 。
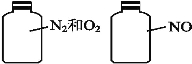
(2)如图,两瓶体积相等的气体,在同温、同压下,原子总数 (填“相等”、“不相等”),当两瓶气体质量相等时,N2和O2的体积比为 。
(3)下列物质所含分子数由多到少的顺序是 。(用A、B、C、D排序)
A.标准状况下33.6 L CO
B.所含电子为4 mol的H2
C.20 ℃时45 g H2O
D.常温下,0.5NA个CO2与0.5NA个CO的混合气体
(4)与50 mL 1mol·L-1 MgCl2溶液中的Cl-物质的量浓度相等的是
A.50 mL 1 mol·L-1 FeCl3溶液
B.25 mL 2 mol·L-1 CaCl2溶液
C.50 mL 2 mol·L-1 KCl溶液
(5)某状况下气体摩尔体积为Vm L/mol, 将a L NH3溶解于水中形成b mL氨水溶液,所得溶液的密度为ρ g/cm3,则氨水的溶质质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJmol﹣1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
下列说法正确的是( )

A.CH3OH的燃烧热(△H)为﹣192.9kJmol﹣1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)
=CO2(g)+2H2(g)的△H>﹣192.9kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com