
科目:高中化学 来源:2017届福建省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列排列的顺序不正确的是( )
A. 热稳定性:HCl>PH3>H2S B. 碱性:NaOH>Mg(OH)2>Al(OH)3
C. 原子半径:Na>S>O D. 结合氢离子能力:CO32->HCO3->SO42-
查看答案和解析>>
科目:高中化学 来源:2017届安徽省六安市高三上第一次月考化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法正确的是
A.黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”, 其中的硝是指硝酸
B.包装食品里常有硅胶、生石灰、还原铁粉三类小包,其作用相同
C. 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同
D.家中做卫生保洁时,不可将“84”消毒液与洁厕精(含浓盐酸)混合使用
查看答案和解析>>
科目:高中化学 来源:2017届安徽省淮北市濉溪县高三上学期9月月考化学试卷(解析版) 题型:选择题
某学生想利用右图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2。下列说法正确的是 ( )

A.烧瓶是干燥的,由B进气,可收集②③④⑥⑦
B.烧瓶是干燥的,由A进气,可收集①⑤
C.在烧瓶中充满水,由A进气,可收集①⑤⑦
D.在烧瓶中充满水,由B进气,可收集⑥
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三上第二次检测化学试卷(解析版) 题型:填空题
电镀废水中常含有NaCN,工业上规定其含量低于0.5 mg/L才可排放,对NaCN超标的废水可用两段氧化法处理:
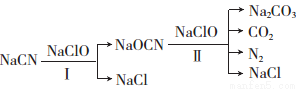
己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同。
请回答下列问题:
(1)第一次氧化时,溶液的pH应调节为______(填“酸性”、“碱性”或“中性”);原因是___________。反应中,欲使1 mol NaCN变为NaOCN,则需要氧化剂NaClO至少为________mol。
(2)写出第二次氧化时发生反应的离子方程式:_____________________。反应中被氧化的元素是__________。
(3)处理10 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO__________g(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准。
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三上第二次检测化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述错误的是( )
A.2.3 g Na在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6 L NH3中含有的氢原子数目为0.75NA
C.1 L 0.1 mol/LH3PO4溶液中含有的离子数目为0.4NA
D.1个CO2分子的质量为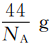
查看答案和解析>>
科目:高中化学 来源:2017届河南省灵宝市高三上学期9月月考化学试卷(解析版) 题型:实验题
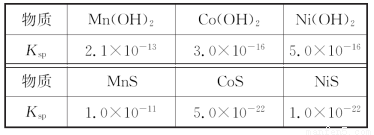
锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下,已知25℃,部分物质的溶度积常数如下:
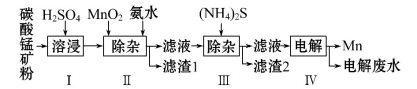
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是______________。
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是__________________,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是________。
(4)步骤Ⅳ中,在________(填“阴”或“阳”)极析出Mn,电极反应为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省灵宝市高三上学期9月月考化学试卷(解析版) 题型:选择题
下列推断正确的是
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源:2017届广东省等四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
Zn还原SiCl4的反应如下:
SiCl4(g) + 2Zn(l) = Si(s) + 2ZnCl2(g) ΔH1
SiCl4(g) + 2Zn(g) = Si(s) + 2ZnCl2(g) ΔH2
下列说法正确的是( )
A.Zn(l)=Zn(g) ΔH =1/2(ΔH1-ΔH2 )
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,ΔH2变大
D.以Zn片、铜片、稀硫酸构成的原电池,Zn片表面有大量气泡产生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com