
| A. | BaSO3和BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO4 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
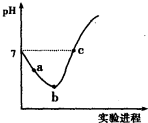
| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
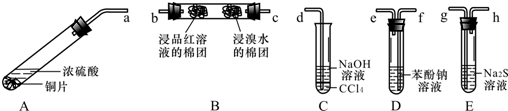
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依次使用Na2CO3溶液和盐酸,可除去锅炉水垢中的CaSO4 | |
| B. | 草木灰溶液能够去除油污 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 若发生液氨泄漏,人应尽量往上风向处较低的位置转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使石蕊试液褪色 | B. | 与足量的NaOH溶液反应生成Na2SO4 | ||
| C. | 不能与过氧化氢(H2O2)溶液反应 | D. | 能使品红褪色,加热后又出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| B. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| C. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 | |
| D. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com