
| A. | $\frac{b-2c}{a}$mol.L-1 | B. | $\frac{2b-c}{a}$mol.L-1 | C. | $\frac{a-b}{a}$mol.L-1 | D. | $\frac{2b-4c}{a}$mol.L-1 |
分析 bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+;另一份与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知,每份中含有cmolSO42-;然后根据溶液不显电性,计算出每份中NO3-的物质的量,再根据c=$\frac{n}{V}$计算出溶液中硝酸根离子的物质的量浓度.
解答 解:bmol烧碱刚好把NH3全部赶出,根据反应NH4++OH-═NH3+H2O可知,每份溶液中含有NH4+的物质的量为bmol,
另一份溶液与BaCl2溶液完全反应,消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知,每份溶液中含有SO42-cmol,
设每份溶液含有的NO3-的物质的量为x,由于溶液不显电性,
则:bmol×1=cmol×2+x×1,
解得:n=(b-2c)mol,
每份溶液的体积为0.5aL,
所以每份溶液硝酸根的浓度为:c(NO3-)=$\frac{(b-2c)mol}{0.5aL}$=$\frac{2b-4c}{a}$mol/L,
根据溶液的均一性可知,原溶液中硝酸根的浓度为:$\frac{2b-4c}{a}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算、离子方程式的简单计算,题目难度中等,注意掌握物质的量浓度的计算方法,明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒为解答本题的关键.


科目:高中化学 来源: 题型:选择题
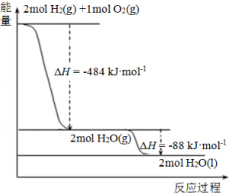
| A. | 926 kJ•mol-1 | B. | 485kJ•mol-1 | C. | 463 kJ•mol-1 | D. | 221 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
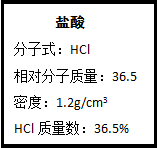 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①②④ | C. | ①②③ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内含少量水 | B. | 氢氧化钠中含有少量碳酸钠 | ||
| C. | 俯视定容 | D. | 溶解后立即定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:3 | B. | 3:1:2 | C. | 3:2:1 | D. | 9:3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com