
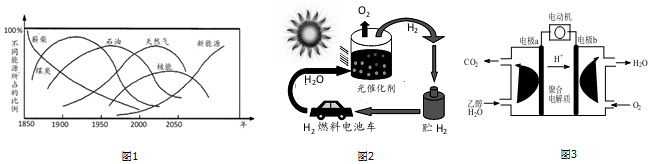
分析 (1)天然气与煤炭、石油等能源相比具有使用安全、热值高、洁净等优势,据此进行分析;
(2)①质子数相同,中子数不同的原子互称为同位素;
②${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子为10-1=9个;
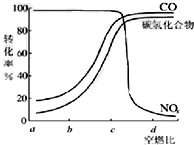
(3)图2是氢能的制备及利用的途径之一,涉及能量转化方式有光能转化为化学能,化学能转化为电能;
(4)①依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量写出热化学方程式;
②a极为负极,失电子发生氧化反应,据此书写电极反应方程式;
③为维持热平衡,即水蒸气重整与氧化重整热量相同,
氧化重整:①C2H5OH(l)+$\frac{3}{2}$O2(g)=2CO2(g)+3H2 (g)△H=-554.0kJ•mol-1
水蒸气重整:②CH3OH(l)+3H2O(l)=2CO2(g)+6H2(g)△H=+174.2kJ•mol-1,要使①②热量相同,即①×174.2,即参加反应的CH3OH为174.2CH3OH,②×554.0,即参加反应的CH3OH为554.0CH3OH,故水蒸气重整的乙醇与氧化重整的乙醇的物质的量之比为554CH3OH:174.2CH3OH=3.18,据此进行分析.
解答 解:(1)天然气与煤炭、石油等能源相比具有使用安全、热值高、洁净等优势,故图1中化石能源中属于较清洁的能源是天然气,
故答案为:天然气;
(2)①质子数相同,中子数不同的原子互称为同位素,故235U、238U、234U 三种核素之间的关系是同位素,
故答案为:同位素;
②${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子为10-1=9个,235g核素${\;}_{92}^{235}$U发生裂变反应净产生的中子(01n)数为9NA,则470g核素${\;}_{92}^{235}$U发生裂变反应净产生的中子(01n)数为18NA,
故答案为:18NA;
(3)图2是氢能的制备及利用的途径之一,涉及能量转化方式有光能转化为化学能,化学能转化为电能,
故答案为:ac;
(4)①依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,25℃、101kPa乙醇的燃烧热为1366.8kJ•mol-1,热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8KJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8KJ/mol;
②a极为负极,失电子发生氧化反应,故电极反应方程式为C2H5OH-12e-+3H2O=2CO2+12H+,
故答案为:C2H5OH-12e-+3H2O=2CO2+12H+;
③为维持热平衡,即水蒸气重整与氧化重整热量相同,
氧化重整:①C2H5OH(l)+$\frac{3}{2}$O2(g)=2CO2(g)+3H2 (g)△H=-554.0kJ•mol-1
水蒸气重整:②CH3OH(l)+3H2O(l)=2CO2(g)+6H2(g)△H=+174.2kJ•mol-1,要使①②热量相同,即①×174.2,即参加反应的CH3OH为174.2CH3OH,②×554.0,即参加反应的CH3OH为554.0CH3OH,故水蒸气重整的乙醇与氧化重整的乙醇的物质的量之比为554CH3OH:174.2CH3OH=3.18,
故答案为:3.18.
点评 本题考查能源使用问题,同位素,能量转化,热化学方程式的书写,以及电极方程式的书写等,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、K+、Br-、CO32- | |
| B. | 0.1 mol/LCa(ClO)2溶液中:Fe2+、A13+、I-、SO42- | |
| C. | 0.1 mol/L Fe2(SO4)3溶液中:NH4+、Cu2+、NO3-、SO42- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:Ca2+、NH4+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
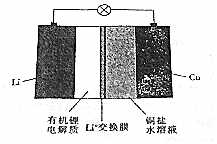
| A. | 放电时,正极上有金属锂析出 | |
| B. | 充电时,阳极区溶液中c(Cu2+)增大 | |
| C. | 放电时,负极区溶液中c(OH-)增大 | |
| D. | 充电时,阴极的电极反应式为Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.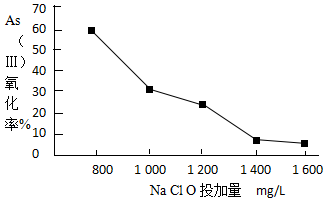
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X与Y只能形成一种化合物 | |
| C. | W的最高价氧化物对应的水化物的酸性比R的强 | |
| D. | Z的简单气态氢化物的热稳定性比R的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
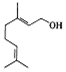
| A. | 分子中含有两种官能团 | |
| B. | lmol该物质与lmolHBr发生加成反应的产物共有5种(不考虑立体异构) | |
| C. | 使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同 | |
| D. | 香天竺葵醇能发生加聚反应和氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com