
【题目】在蒸馏实验中,下列叙述不正确的是
A. 蒸馏实验之前放入几粒沸石B. 将温度计水银球插入自来水中
C. 冷水从冷凝管下口入,上口出D. 收集蒸馏水时,应弃去开始馏出的部分
科目:高中化学 来源: 题型:
【题目】将少量SO2通入Ca(ClO)2溶液中,下列离子方程式能正确表示该反应的是( )
A.SO2+H2O+Ca2++2ClO﹣→CaSO4↓+HClO+H++Cl﹣
B.SO2+H2O+Ca2++2ClO﹣→CaSO3↓+2H++2ClO﹣
C.SO2+H2O+Ca2++2ClO-→CaSO3↓+2HClO
D.SO2+H2O+Ca2++2ClO-→CaSO4↓+2H++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g钠投入到97.8g水中,反应完毕后,得到100mL的溶液.求:
(1)产生氢气在标况下的体积 .
(2)所得氢氧化钠溶液的溶质质量分数 .
(3)所得氢氧化钠溶液的物质的量浓度 .
(4)在K2Cr2O7+14HCl═2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3mol电子转移时生成Cl2的体积为(标准状况),被氧化的HCl的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 0.1 mol/L的![]() 溶液中加入100mL溶有2.08 g
溶液中加入100mL溶有2.08 g ![]() 的溶液,再加入100mL溶有0.01mol
的溶液,再加入100mL溶有0.01mol ![]() ·
·![]() 的溶液,充分反应(
的溶液,充分反应(![]() 微溶,AgCl、
微溶,AgCl、![]() 比
比![]() 更易沉淀)。下列说法中正确的是
更易沉淀)。下列说法中正确的是
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中, ![]()
D. 在最终得到的溶液中, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在酸性溶液中易被还原成
在酸性溶液中易被还原成![]() ,且
,且![]() 、
、![]() 、
、![]() 、
、![]() 的氧化性依次减弱。下列叙述中,正确的是
的氧化性依次减弱。下列叙述中,正确的是
A. ![]() 通入
通入![]() 溶液中,可存在反应3
溶液中,可存在反应3![]() +6
+6![]() ====2
====2![]() +4
+4![]()
B. 每1 mol ![]() 在酸性溶液中被氧化生成
在酸性溶液中被氧化生成![]() 时转移2 mol
时转移2 mol ![]()
C. ![]() 溶液能将KI溶液中的I-氧化
溶液能将KI溶液中的I-氧化
D. I2具有较强的氧化性,可以将![]() 氧化成
氧化成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)Fe3+具有氧化性,实验室测定含碘废液中I﹣的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2molL﹣1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500molL﹣1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(i)在盛有废液的锥形瓶中先加入5mL 2molL﹣1 H2SO4的目的是 . (用离子方程式和语言叙述解释)
(ii)上述过程中涉及的反应:①2Fe3++2I﹣═2Fe2++I2② .
(iii)根据滴定有关数据,该废液中I﹣含量是gL﹣1 .
(iv)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是 .
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
(2)Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(i)设计实验①的目的是 .
(ii)实验③可得出结论是 .
(iii)写出实验②中反应的离子方程式
(iv)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4 . H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl.据此,某学生设计了下列实验.
(1)【制备NaClO溶液】实验装置如图甲所示(部分夹持装置已省略)
已知:3NaClO ![]() 2NaCl+NaClO3
2NaCl+NaClO3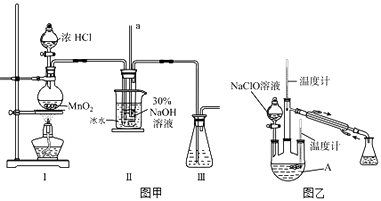
(i)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有(填字母).
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(ii)装置工中发生的离子反应方程式是;Ⅱ中玻璃管a的作用为;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的
(2)【制取水合肼】实验装置如图乙所示
仪器A的名称为;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4H2O参与A中反应并产生大量氮气,产品产率因此降低,请
写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品.
(3)【测定肼的含量】
称取馏分0.3000g,加水配成20.0mL溶液,在一定条件下,用0.1500molL﹣1 的I2溶液滴定.
已知:N2H4H2O+2I2=N2↑+4Hl+H2O.
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4 . H2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究浓硫酸和铜的反应,下列装置或操作正确的是( )
A.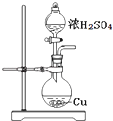
用装置进行铜和浓硫酸的反应
B.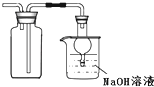
用装置收集二氧化硫并吸收尾气
C.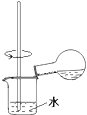
用装置稀释反应后的混合液
D.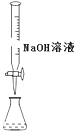
用装置测定余酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂.
(1)磷元素位于元素周期表第_周期_族.AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为 .
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:
CuSO4+PH3+H2O═ Cu3P↓+H3PO4+H2SO4
(3)工业制备PH3的流程如图所示.
①黄磷和烧碱溶液反应的化学方程式为 , 次磷酸属于(填“一”“二”或“三”)元酸.
②若起始时有1molP4参加反应,则整个工业流程中共生成 mol PH3 . (不考虑产物的损失)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com