
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
分析 钠性质活泼,可与水反应生成氢氧化钠和氢气,与氧气在点燃条件下反应生成淡黄色的过氧化钠,过氧化钠和二氧化碳反应生成氧气,可用于供氧剂,结合氯气的性质解答该题.
解答 解:①钠在空气中燃烧生成淡黄色的过氧化钠,故错误;
②钠投入硫酸铜溶液中,生成氢氧化铜和氢气,故错误;
③过氧化钠可与二氧化碳反应生成氧气,可在防毒面具中做供氧剂,故正确;
④氯气具有强氧化性,铁丝在氯气中燃烧生成棕色的FeCl3,故正确;
⑤氢气在氯气中燃烧产生白雾,故错误,
故选C.
点评 本题综合考查钠、钠的化合物以及氯气的性质与用途,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在发生化学反应时,甲原子失电子数比乙原子多 | |
| B. | 甲的阳离子的氧化性比乙离子强 | |
| C. | 甲的氢氧化物的碱性小于乙的氢氧化物的碱性 | |
| D. | 在甲、乙、硫酸组成的原电池中,甲为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 0.30mol Fe粉与足量水蒸气反应生成的H2分子数为0.40NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g NH3和18 g H2O中含有的电子数均为10NA | |
| B. | 2 L 1.5 mol•L-1醋酸溶液中含有的CH3COO-数为3NA | |
| C. | 标准状况下,5.6 L Cl2溶解于足量NaOH溶液中,转移的电子数为0.5NA | |
| D. | 恒压密闭容器中充入2 mol NO与1 mol NO2,容器中分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中安静燃烧,发出苍白色火焰 | |
| B. | 铁丝在氯气中燃烧,产生棕褐色的烟 | |
| C. | 铜丝在氯气中燃烧,产生棕黄色的烟 | |
| D. | 钠在氯气中燃烧,产生黄色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
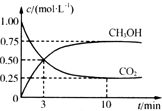 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L水中含有的分子数目为0.2NA | |
| B. | 1 mol•L-1 的CaCl2溶液中,含有氯离子数2NA | |
| C. | 23g Na与足量O2反应转移的电子数为NA | |
| D. | 1mol苯中含有“C=C”的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
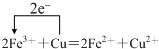 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com