
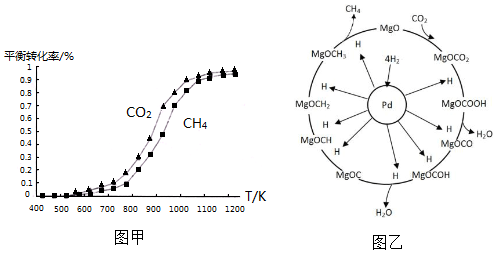
 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.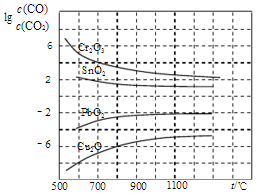
分析 (1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
根据盖斯定律①+②-③可得;
(2)①根据图示可以看出,CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0;
(3)根据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”结合反应机理来书写方程式并结合化合价判断;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变;
B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合;
C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高;
D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0;
(5)依据电解原理阴极上是得到电子发生还原反应生成一氧化碳.
解答 解:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
根据盖斯定律①+②-③得到反应CO2(g)+CH4(g)═2CO(g)+2H2(g),△H=+247kJ/mol;
故答案为:+247;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;
故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行;
故答案为:△S>0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2 CH4+2H2O;
CH4+2H2O;
故答案为:CO2+4H2  CH4+2H2O;
CH4+2H2O;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故A错误;
B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合B正确;
C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高,故C正确;
D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0,故D错误;
故答案为:BC;
(5)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2$\frac{\underline{\;电解\;}}{\;}$2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O;
故答案为:4OH--4e-=O2↑+2H2O.
点评 本题主要考查了盖斯定律的应用、电极方程式及其化学方程式的书写、根据图象对平衡移动的判断等,重在培养学生能够利用化学知识提取题干的信息进行答题的能力,综合性强,难度较大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L N2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2gH2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子22.4L | |
| D. | 1L含NA个NH3•H2O的氨水,其浓度为1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com