
| A. | 31 g白磷含有P-P键的总数为6 NA | |
| B. | 1.6 g NH2?离子含有电子总数为NA | |
| C. | 1 L1 mol•L-1FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 标准状况,22.4 L NO和 22.4 L O2的混合气体所含分子数为1.5NA |
分析 A、求出白磷P4的物质的量,然后根据1mol白磷中含6molp-p键来分析;
B、求出NH2?的物质的量,然后根据1molNH2?中10mol电子来分析;
C、Fe3+是弱碱阳离子,在溶液中会水解;
D、一氧化氮与氧气反应生成二氧化氮,二氧化氮部分转化成四氧化二氮.
解答 解:A、31g白磷P4的物质的量为n=$\frac{31g}{31×4g/mol}$=0.25mol,而1mol白磷中含6molp-p键,故0.25mol白磷中含1.5molp-p键,即1.5NA个,故A错误;
B、1.6gNH2?的物质的量为0.1mol,而1molNH2?中10mol电子,故0.1molNH2?中含1mol电子即NA个,故B正确;
C、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于NA个,故C错误;
D、标准状况,22.4 L NO和 22.4 L O2的物质的量均为1mol.1mol NO与1mol O2混合后生成1mol二氧化氮,氧气剩余0.5mol,由于部分二氧化氮转化成四氧化二氮,所以气体分子数小于1.5NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入HCl | B. | 加少量NH4Cl固体 | C. | 加少量NaCl固体 | D. | 通入氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
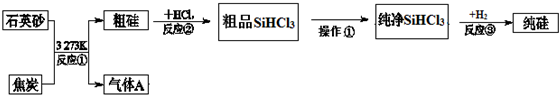
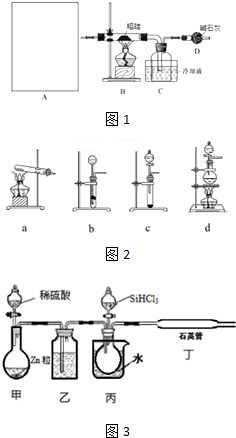
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com