
用价电子对互斥理论判断SO3的分子构型为( )
A.正四面体形 B.V形
C.三角锥形 D.平面三角形
科目:高中化学 来源: 题型:
下列物质中:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气
回答下列问题:
(1)不存在化学键的是________;
(2)存在金属键的是________;
(3)只存在非极性键的是________;
(4)只存在离子键的是________;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________;
查看答案和解析>>
科目:高中化学 来源: 题型:
有关晶体(晶胞)的结构如下图所示,下列说法不正确的是( )

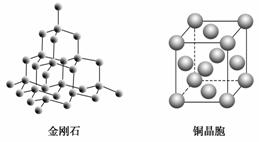
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1∶4
D.铜晶体为面心立方堆积,铜原子的配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
在形成氨气分子时,氮原子中的原子轨道发生sp3杂化生成4个________________,生成的4个杂化轨道中,只有________个含有未成对电子,所以只能与____________个氢原子形成共价键,又因为4个sp3杂化轨道有______________,所以氨气分子中的键角与甲烷不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)根据等电子原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:________和________;________和________。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO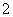 互为等电子体的分子有:________。
互为等电子体的分子有:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
从我们熟悉的食盐、金属、冰到贵重的钻石等都是晶体,而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部基本构成微粒是否按一定规律做周期性重复排列
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于离子键的说法中正确的是( )
A.离子键一定在活泼金属和活泼非金属元素的原子之间形成
B.形成离子键时离子间的静电作用指的是静电吸引
C.形成离子键时,离子半径越大离子键就越强
D.非金属元素的原子之间也可以形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA( )
(2)标准状况下,22.4 L NO2气体中所含分子数目为NA( )
(3)100 g 17%的氨水,溶液中含有的NH3分子数为NA( )
(4)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com