
 如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )| A. | 随着反应进行,阴极PH逐渐减小 | |
| B. | OH-通过隔膜进入B池 | |
| C. | B池电极发生反应为2H2O+4e-4═H++O2↑ | |
| D. | 每转移2mol电子生成2g H2 |
分析 依据电解原理:4Kr2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑可知,溶液中氢离子离子在阴极放电,氢氧根离子在阳极放电,则不锈钢为阴极,惰性电极为阳极,结合电极反应和离子浓度变化分析.
解答 解:A、电解时溶液中氢离子离子在阴极放电,则阴极室氢离子浓度减小,pH增大,故A错误;
B、因为是阳离子交换膜,所以OH-不能通过隔膜进入B池,故B错误;
C、B池惰性电极上氢氧根离子失电子生成氧气,则其电极方程式为:2H2O-4e-═4H++O2↑,故C错误;
D、不锈钢为阴极,溶液中氢离子离子在阴极放电生成氢气,所以每转移2mol电子生成2g H2,故D正确.
故选D.
点评 本题考查了电解池原理分析判断,注意根据电极方程式判断两极的产物以及电极材料,题目难度中等,侧重于考查学生对电解知识的综合应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系:
A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

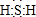 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次与100ml稀硝酸反应剩4.8g金属为Cu和Fe | |
| B. | 反应前稀硝酸的物质的量的浓度为1.5 mol•L-1 | |
| C. | 若向上述最后所得溶液中再加入足量的稀硝酸还可得到标况下0.56LNO | |
| D. | 原混合物中Cu和Fe的物质的量分别为0.06mol和0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组别 | 温度/℃ | V(H2C2O4) /mL | V(KMnO4) /mL | V(H2O) /mL | KMnO4溶液 褪色时间/s |
| 1 | 30 | 10 | 10 | 20 | 40 |
| 2 | 30 | 20 | 20 | 0 | t |
| 3 | 30 | 15 | 10 | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | B. | Mg2+ N${H}_{4}^{+}$ S${O}_{4}^{2-}$ Cl- | ||
| C. | Na+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | D. | Ba2+ Na+ Mn${O}_{4}^{-}$ S${O}_{4}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com