
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
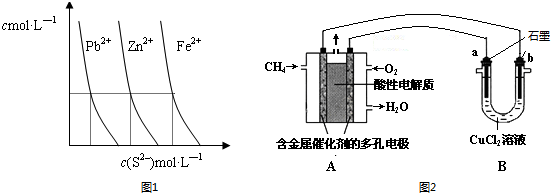
分析 (1)①酸越弱,其盐的酸根水解程度越大;
②因加入盐酸,醋酸的电离平衡逆向移动,则c(CH3COO-)减小,醋酸的电离程度减小,但温度不变,则醋酸电离平衡常数不变,加盐酸时c(H+)增大;
(2)由图象可知Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),以此解答;
(3)酸性条件下,甲烷为原电池的负极,被氧化生成二氧化碳和水;结合电极方程式根据转移电子与物质之间的关系解答.
解答 解:(1)①电离常数越小,酸越弱,其盐的酸根水解程度越大,盐溶液的pH越大,酸性:CH3COOH>H2CO3>HCN>HCO3-,所以盐溶液的pH:Na2CO3>NaCN>NaHCO3>CH3COONa,即pH由大到小的顺序为cbda;
故答案为:cbda;
②因加入盐酸,醋酸的电离平衡逆向移动,则c(CH3COO-)减小,醋酸的电离程度减小,但温度不变,则醋酸电离平衡常数不变,Kw不变,加盐酸时c(H+)增大,
故答案为:a;
(2)由图象可知Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),如果向三种沉淀中加盐酸,最先溶解的是FeS,向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为溶度积最小的PbS,
故答案为:FeS;PbS;
(3)①酸性条件下,甲烷为原电池的负极,被氧化生成二氧化碳和水,电极方程式为CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+;
②B为电解氯化铜装置,阳极生成氯气,阴极析出铜,则b为阴极,质量增大,当线路中有0.1mol电子通过时,阴极析出0.05mol铜,质量为3.2g,
故答案为:b;3.2.
点评 本题考查较为综合,涉及盐类的水解、难溶电解质的转化以及燃料电池等知识,侧重于学生的分析能力和计算能力的考查,注意相关基础知识的积累,难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 气体 | 溶液 | 现象 |  |
| A | NH3 | H2O含酚酞 | 红色喷泉 | |
| B | Cl2 | 饱和食盐水 | 无色喷泉 | |
| C | HCl | H2O含石蕊 | 红色喷泉 | |
| D | SO2 | NaOH溶液 | 无色喷泉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高溶液的温度 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol•L-1盐酸 | D. | 将溶液稀释到原体积的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一列的元素都是金属元素 | |
| B. | 第三列所含的元素种类最多 | |
| C. | 第18列元素原子的最外层电子数均为8 | |
| D. | 只有第二列元素的最外层电子数为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:
元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸可以干燥H2、NH3、CO2等气体 | |
| D. | SO2的漂白原理与次氯酸相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )| A. | t3时减小了压强 | |
| B. | t5时增大了压强 | |
| C. | t6时刻后反应物的转化率最低 | |
| D. | t1时该反应的平衡常数大于 t6时反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,甲烷和强酸、强碱、强氧化剂不起反应 | |
| B. | 光照下甲烷与氯气发生取代反应 | |
| C. | 甲烷的氯代物CHCl3、CCl4都难溶于水 | |
| D. | 甲烷在光照条件下与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 13种 | C. | 14种 | D. | 15种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com