
(8分)已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:
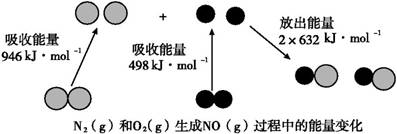
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为 kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式: 。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为: 。
当有16 g O2(g)生成时,该反应中放出的热量为: kJ。
(1)946(2分); N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1(2分)
(2)2NO(g)=N2(g)+O2(g) ΔH=-180 kJ·mol-1(2分); 90(2分)
【解析】(1)根据示意图可知,N≡N键的键能为946kJ/mol。反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此根据键能可知,该反应的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,所以该反应的热化学方程式是N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1。
(2)正反应是吸热反应,则逆反应是放热反应,所以NO(g)分解生成N2(g)和O2(g)的热化学方程式为2NO(g)=N2(g)+O2(g) ΔH=-180 kJ·mol-1。16g氧气是0.5mol,所以放出的热量是180 kJ·mol-1×0.5mol=90kJ。


科目:高中化学 来源: 题型:阅读理解
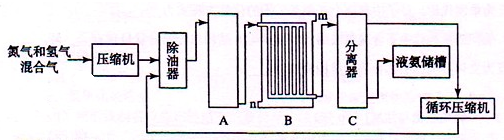
| ||
| ||
| ||
| △ |
| ||
| △ |
| 高温、高压 |
| 催化剂 |
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ②H30+ |
| ||
| 过氧化物 |
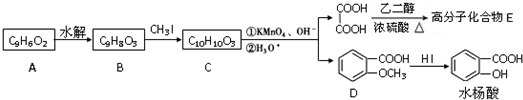
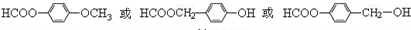
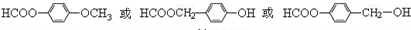
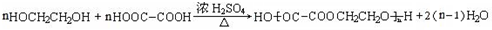
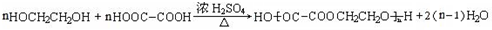
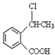 为原料制备
为原料制备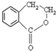 的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下: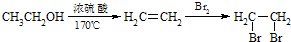
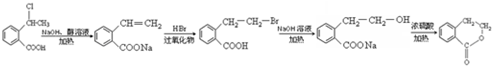

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
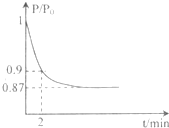 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.| 1 |
| 2 |
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省东山县第二中学高二第一次月考化学试卷(带解析) 题型:填空题
(8分)已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化: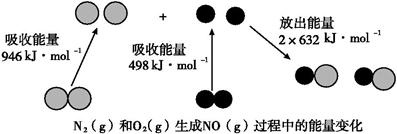
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为 kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式: 。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为: 。
当有16 g O2(g)生成时,该反应中放出的热量为: kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com