
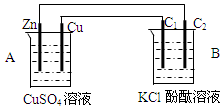
 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题分析 (1)该装置中A能自发的进行氧化还原反应为原电池,B为电解池;
(2)锌、铜原电池中,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电,据此回答判断.
解答 解:(1)A中金属锌和硫酸铜之间能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)A中锌电极上失电子生成锌离子进入溶液,Zn-2e-=Zn2+,铜电极上铜离子得电子生成铜单质,2e-+Cu2+=Cu,在电解质的阴极上,根据阳离子放电顺序,是氢离子得电子,析出氢气的过程,所以该极附近溶液显示碱性,阳极上是氯离子失电子析出氯气的过程,2Cl--2e-=Cl2↑,
故答案为:正;2e-+Cu2+=Cu;阳;2Cl--2e-=Cl2↑;有气泡产生,溶液变红.
点评 本题考查了原电池和电解池原理,根据是否能自发进行反应结合原电池构成条件来确定原电池,正确判断原电池和电解池是解本题关键,难点是电极反应式的书写,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
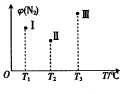 分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )
分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )| A. | 在t min时,Ⅱ和Ⅲ一定达平衡状态 | |
| B. | 2v(NH3)=3v(H2)时,三个容器均达平衡状态 | |
| C. | 平衡后容器Ⅰ中混合气体的平均相对分子质量最小 | |
| D. | 已知tmin时,Ⅲ中c(N2)=1mol/L,此时反应平衡常数K=0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4+所含质子数为10 NA | |
| B. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| C. | 常温常压下,22.4 LSO2所含的分子数为NA | |
| D. | 常温常压下,32 gO2和O3的混合气体所含原子数为 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
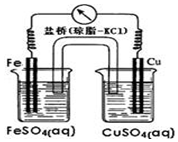
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
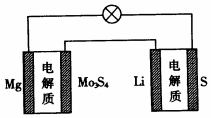 已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )
已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )| A. | 镁电池放电时,Mg2+向负极迁移 | |
| B. | 镁电池放电时,正极发生的电极反应为Mo3S4+2xe-=Mo3S42- | |
| C. | 理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量) | |
| D. | 图中Li作负极,Mo3S4作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com