
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2;②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是 ( )
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO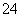 >IO
>IO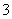 >I2
>I2
D.反应①、②中生成等量的I2时转移电子数之比为1∶5
科目:高中化学 来源: 题型:
下图是元素周期表的一部分
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(1)元素⑨的价电子轨道表示式为 ▲ ,元素⑩的次外层电子数为 ▲ 个。
 (2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 ▲ 。
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 ▲ 。
 (3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式 ▲ 。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式 ▲ 。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 ▲ 。(填元素代号)
②T元素最可能是 ▲ (填“s”、“p”、“d”、“ds”等)区元素,位于 ▲ 族;
若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4===2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.CuI既是氧化产物又是还原产物
B.Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和 碘元素被还原
碘元素被还原
C.每生成1 mol CuI,有12 mol KI发生氧化反应
D.每转移1.1 mol电子,有0.2 mol 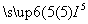 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3―→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是 ( )
A.生成40.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.25 mol
D.被还原的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.根据反应Cu+H2SO4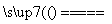 CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B.在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂
C.反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO +Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②中电子转移的方向和数目:MnO +CuS
+CuS
Ⅱ.在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。由上述反应得出的物质氧化性强弱的结论是________>________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既是氧化还原反应,又是吸热反应的是( )。
A.铝片与稀H2SO4的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应 D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
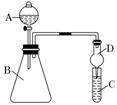 某同学为探究元素周期表中元素性质的递变规律,利用右图装置验证同主族元素非金属性的变化规律。
某同学为探究元素周期表中元素性质的递变规律,利用右图装置验证同主族元素非金属性的变化规律。
(1)仪器B的名称为____________,干燥管D的作用为防止____________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为_______________ ________________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________________溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加________________(写化学式)溶液,若观察到 C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装
C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装 有________________溶液的洗气瓶。
有________________溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
含气体杂质的乙炔4.1g与H2加成生成饱和链烃,共用去标准状况下4.48LH2,则气体杂质不可能是
A.乙烷 B.乙烯 C.丙炔 D.1, 3-丁二烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com