
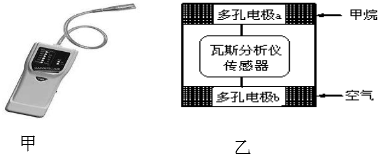
| A. | 电极b是正极,内电路中O2-由电极b流向电极a | |
| B. | 电极a的反应式为:CH4+4O2--8e-═CO2+2H2O | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| D. | 当固体电解质中有1mol O2-通过时,电子转移2mol |
分析 该装置是燃料电池,通入甲烷的电极a是负极、通入空气的电极b是正极,放电时,负极反应式为CH4+4O2--8e-═CO2+2H2O,正极反应式为O2+4e-=2O2-,电子从负极沿导线流向正极,原电池内部阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.该原电池中,正极上氧气得电子发生还原反应,所以通入空气的电极b是正极,内电路中阴离子向负极移动,所以O2-由电极b流向电极a,故A正确;
B.a是负极,负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4+4O2--8e-═CO2+2H2O,故B正确;
C.电子不进入原电池内部,内电路是通过阴阳离子定向移动形成电流,故C错误;
D.每个O原子得到2个电子生成O2-,所以当固体电解质中有1mol O2-通过时,电子转移2mol,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确正负极判断方法、离子及电子移动方向、电极反应式的书写等即可解答,难点是电极反应式的书写,易错选项是C.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、ClO-、Cl2三种微粒只具有氧化性,没有还原性 | |
| B. | Cl2具有强氧化性,可以把水中的氧置换出来 | |
| C. | 因为SO2具有还原性,所以与氯水可以反应生成H2SO4和HCl | |
| D. | Cl2转变为HClO时一定需要加入氧化剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定氯水的pH | |
| B. | 用焰色反应鉴别NaCl和KNO3 | |
| C. | 用AgNO3溶液鉴别NO2和Br2蒸气 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的HCl杂质气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
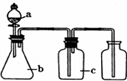 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| B. | 纤维素在人体内可以水解为葡萄糖,故可作人类的营养物质 | |
| C. | 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ | |
| D. | “地沟油”禁止食用,但可以用来做肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com