
加入稀盐酸或通入H2S均能产生沉淀和无色水溶液是( )
A.Pb2+、Ba2+、Ag+ B.Ag+、Fe3+、Mg2+
C.Ag+、Cu2+、K+ D.Hg2+、Ag+、Na+
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
(1)写出以上叙述中涉及的化学方程式:
①________________________________ ;?
②________________________________ ;?
③________________________________ ;?
④________________________________ 。?
(2)制取甲硅烷的装置与制取_______(填“H2”或“O2”)的装置相似。?
(3)加入稀盐酸之前后应向密闭装置中通入氮气一会儿,其目的是________________________。
(4)为研究甲硅烷的化学性质,进行了如下实验:?
①将甲硅烷通入少量的硝酸银溶液中,发现有沉淀生成,后经测定知该沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀。向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。将甲硅烷通入硝酸银溶液中发生反应的化学方程式为________________。?
②制取甲硅烷后,检验装置中是否有残留的甲硅烷的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和硅的性质相似。碳的最简单的氢化物是甲烷,硅的最简单的氢化物称为甲硅烷(SiH4)。甲硅烷是一种无色无味的气体(其密度比空气大),不易溶于水,其化学性质比甲烷活泼。在实验室里制取甲硅烷的方法是:将白净细沙(SiO2)与镁粉混合起来,灼烧到反应物转变为灰黑色的硅化镁(Mg2Si)和白色的氧化镁后冷却到室温;取一定量的灼烧后的残留物,置于制取甲硅烷的装置中,滴加稀盐酸后立即有甲硅烷气体逸出,并迅速地自燃。?
(1)写出以上叙述中涉及的化学方程式:
①________________________________ ;?
②________________________________ ;?
③________________________________ ;?
④________________________________ 。?
(2)制取甲硅烷的装置与制取_______(填“H2”或“O2”)的装置相似。?
(3)加入稀盐酸之前后应向密闭装置中通入氮气一会儿,其目的是________________________。
(4)为研究甲硅烷的化学性质,进行了如下实验:?
①将甲硅烷通入少量的硝酸银溶液中,发现有沉淀生成,后经测定知该沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀。向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。将甲硅烷通入硝酸银溶液中发生反应的化学方程式为________________。?
②制取甲硅烷后,检验装置中是否有残留的甲硅烷的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中用镁制取硅的反应为:2Mg+SiO2![]() 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si![]() Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430![]() )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的 。
(2)当接通电源引发反应后,切断电源,反应能继续进行,其原因是
。证明了反应物Mg与SiO2具有的总能量 (填“大于”、“小于”或“等于”)生成物MgO和Si具有的总能量。
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗中加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知 在空气中能自燃。燃烧的热化学方程式为
,当产生等量的热量时,燃烧CH4和SiH4的物质的量之比为 (CH4的燃烧热是890![]() )
)
查看答案和解析>>
科目:高中化学 来源:2010届江西省上高二中高三上学期第四次月考(理综)化学部分 题型:实验题
镁是很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中用镁制取硅的反应为:2Mg+SiO2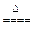 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si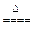 Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430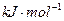 )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题: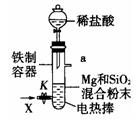
(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的 。
(2)当接通电源引发反应后,切断电源,反应能继续进行,其原因是
。证明了反应物Mg与SiO2具有的总能量 (填“大于”、“小于”或“等于”)生成物MgO和Si具有的总能量。
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗中加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知 在空气中能自燃。燃烧的热化学方程式为
,当产生等量的热量时,燃烧CH4和SiH4的物质的量之比为 (CH4的燃烧热是890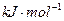 )
)
查看答案和解析>>
科目:高中化学 来源:2010届江西省高三上学期第四次月考(理综)化学部分 题型:实验题
镁是很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中用镁制取硅的反应为:2Mg+SiO2 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430 )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的 。
(2)当接通电源引发反应后,切断电源,反应能继续进行,其原因是
。证明了反应物Mg与SiO2具有的总能量 (填“大于”、“小于”或“等于”)生成物MgO和Si具有的总能量。
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗中加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知 在空气中能自燃。燃烧的热化学方程式为
,当产生等量的热量时,燃烧CH4和SiH4的物质的量之比为 (CH4的燃烧热是890 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com