
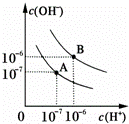
已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 .
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(3)曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8.请分析其原因: .
考点: 离子积常数;酸碱混合时的定性判断及有关ph的计算.
专题: 电离平衡与溶液的pH专题.
分析: (1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH﹣)都减小;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.
解答: 解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH﹣)小;
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH﹣)=n(H+),则V(NaOH)•10﹣5 mol•L﹣1=V(H2SO4)•10﹣4 mol•L﹣1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(3)曲线B对应温度下,pH=2的盐酸溶液和pH=10的某BOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH﹣,使溶液呈碱性,
故答案为:BOH为弱碱,c(BOH)≫c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性.
点评: 本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 等体积pH=3的酸溶液和pH=11的碱溶液相互混合后,溶液的pH一定等于7(25℃)
B. 固态磷酸是电解质,所以磷酸在熔化时或溶解于水时都能导电
C. 锌与pH=3的CH3COOH 溶液反应比pH=4 的盐酸反应剧烈
D. 在0.1 mol/L Na2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32﹣)+c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用做印刷电路铜板腐蚀剂,反应的离子方程式是 .
(2)硫酸铁可做絮凝剂,常用于净水,其原理是
(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是 .
(3)磁铁矿冶炼铁的原理是Fe3O4+4CO=3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移的电子的物质的量是 .
(4)表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
选项 陈述Ⅰ 陈述Ⅱ 判断
A 铁是地壳中含量最高的金属元素 铁是人类最早使用的金属材料 Ⅰ对;Ⅱ对;有
B 常温下铁与稀硫酸反应生成氢气 高温下氢气能还原氧化铁得到铁 Ⅰ对;Ⅱ对;无
C 铁属于过渡元素 铁和铁的某些化合物可用做催化剂 Ⅰ错;Ⅱ对;无
D 在空气中铁的表面能形成致密的氧化膜 铁不能与氧气反应 Ⅰ对;Ⅱ对;有
查看答案和解析>>
科目:高中化学 来源: 题型:
某碱性溶液中只含有Na+、CH3COO﹣、H+、OH﹣四种离子.下列描述正确的是()
A. 该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B. 该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C. 该溶液中离子浓度一定为c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 加入一定量冰醋酸,c(CH3COO﹣)可能大于、等于或小于c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A(g)+3B(g)⇌2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是()
A. v(A)=0.01 mol/(L•s) B. v(B)=0.04 mol/(L•s)
C. v(B)=0.60mol/(L•min) D. v(C)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是( )
|
| A. | K+、Mg2+、NO3﹣、Cl﹣ | B. | Ba2+、Na+、CO32﹣、OH﹣ |
|
| C. | Mg2+、Ba2+、OH﹣、NO3﹣ | D. | H+、K+、CO32﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既属于化合反应,又属于氧化还原反应的是( )
|
| A. | Fe+2HCl=FeCl2+H2↑ | B. | 2FeCl2+Cl2=2FeCl3 |
|
| C. | CaO+H2O=Ca(OH)2 | D. | 2Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是()
A. 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
B. Cu溶于稀硝酸HNO3:Cu+2H++NO3﹣═Cu2++NO2↑+H2O
C. Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42﹣+Ba2++3OH﹣═Fe(OH)3↓+BaSO4↓
D. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com