
【题目】下列离子方程式书写正确的是
A.碳酸钙溶于过量的乙酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.氟气与水反应:F2+H2O=H++F-+HFO
C.溴化亚铁溶液中通人少量氯气:2Fe2++C12=2Fe3++2Cl-
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
【答案】C
【解析】
A.乙酸在离子反应中保留化学式;
B.反应生成HF和氧气;
C.还原性亚铁离子大于溴离子,少量氯气只氧化亚铁离子;
D.生成胶体,不是沉淀。
A.碳酸钙溶于过量的乙酸的离子反应为CaCO3+2CH3COOH=Ca2++CO2↑+H2O+CH3COO-,故A错误;
B.氟气与水反应为2F2+2H2O=4HF+O2,故B错误;
C.溴化亚铁溶液中通人少量氯气的离子反应为2Fe2++C12=2Fe3++2Cl-,所以C选项是正确的;
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的离子反应为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故D错误;
Fe(OH)3(胶体)+3H+,故D错误;
综上所述,本题正确选项C。


科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以 H3AsO3 形式存在)含量极高,为控制砷的排放, 某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多 2 个电子层,砷在元素周期表的位置为_____。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反 应的离子方程式为_____。
(2)电镀厂的废水中含有的 CN-有剧毒,需要处理加以排放。处理含 CN-废水的方法之一是在 微生物的作用下,CN-被氧气氧化成 HCO3- ,同时生成 NH3,该反应的离子方程式为_____。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子, A―表示乳酸根离子):
①阳极的电极反应式为_____
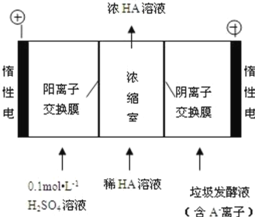
②电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的 OH-可忽略不 计。400 mL 10 g·L-1 乳酸溶液通电一段时间后, 浓度上升为 145 g/L(溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____L (已知:乳酸的摩尔质量为 90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中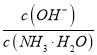 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.将100 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到100 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.0.1 mol·L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
D.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确

A. 放电时K+移向负极
B. 放电时电池负极的电极反应为H2-2e-===2H+
C. 放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
D. 该电池充电时将碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法错误的是
A. 等物质的量的Na2O和Na2O2中含有的阴离子数均为NA
B. 常温常压下14gCO和N2的混合气体中含有的原子数为NA
C. 1L1mol/L的亚硫酸溶液中氢离子数小于2NA
D. 18g铝溶于NaOH溶液或盐酸转移电子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1 NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(2)25℃时,H2SO3![]() HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中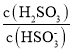 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,物质的量浓度均为0.1molL-1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(H+)=_____molL﹣1,
(4)①0.100molL-1NH4HCO3溶液中物质的量浓度最大的离子是__________(填化学式);②CH3COOH与NaOH反应后的溶液中存在:c(Na+)<c(CH3COO-),该溶液呈_________性(填“酸”“碱”或“中”),该溶液的溶质是______。(填化学式)
(5)下列说法正确的是_____。
a.c(NH4+):①>②
b.物质的量浓度和体积均相等的NaCl和NaX两种溶液中,离子总数相等
c.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1molL-1
d.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(6)某同学欲用0.1molL-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com