
分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算出反应2min内用A表示的反应速率;
(2)计算出各种的反应速率,然后利用计量数与反应速率成正比计算y、q;
(3)根据化学计量数计算出消耗B的物质的量,然后根据转化率=$\frac{消耗物质的量量}{总物质的量}$×100%;
(4)增大容器容积,减小了压强,反应速率减小.
解答 解:(1)反应2min时,A的浓度减少了$\frac{1}{2}$,A减少的物质的量为$\frac{1}{2}$mol,则反应2min内,vA=$\frac{\frac{\frac{1}{2}mol}{2L}}{2min}$=$\frac{m}{8}$mol/(min•L),
故答案为:$\frac{m}{8}$mol/(min•L);
(2)反应2min内vA=$\frac{\frac{\frac{1}{2}mol}{2L}}{2min}$=$\frac{m}{8}$mol/(min•L),vC=$\frac{1}{3}$vA=$\frac{m}{24}$mol/(min•L),v(B)=$\frac{\frac{\frac{m}{3}mol}{2L}}{2min}$=$\frac{m}{12}$mol/(min•L),v(D)=$\frac{\frac{mmol}{2L}}{2min}$=$\frac{m}{4}$mol/(min•L),
化学反应速率与化学计量数成正比,则x:y:p:q=$\frac{m}{8}$mol/(min•L):$\frac{m}{12}$mol/(min•L):$\frac{m}{24}$mol/(min•L):$\frac{m}{4}$mol/(min•L)=3:2:1:6,则y=2、q=6,
故答案为:2; 6;
(3)根据(2)可知,该反应为3A(g)+2B(g)═C(g)+6D(g),反应平衡时D为1.5m mol,根据反应可知,反应消耗B的物质的量为:1.5m mol×$\frac{2}{6}$=0.5m mol,则B的转化率为:$\frac{0.5mmol}{nmol}$×100%=$\frac{0.5m}{n}$×100%,
故答案为:$\frac{0.5m}{n}$×100%;
(4)如果其他条件不变,将容器的容积变为3L,由于容器容积增大,压强减小,各组分的浓度减小,与上述反应比较反应速率会减小,
故答案为:减少; 体积变大,浓度变小 反应速率变小.
点评 本题据考查了化学平衡的计算,题目难度中等,涉及转化率、化学反应速率的计算及其影响因素等知识,明确化学反应速率与化学计量数的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
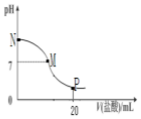 向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+) | |
| D. | p点处的溶液中存在:2 c(NH4+)+2c(NH3•H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应: ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、SO42-、Cl- | D. | Na+、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰水与盐酸的反应 OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com