
【题目】CO2(g)与H2S(g)在高温的反应为CO2(g)+H2S(g)![]() COS(g)+H2O(g),在620K时将0.1mol的CO2(g)与0.4molH2S加入体积为2.5L的空钢瓶中,平衡后H2O(g)的体积分数为0.03,将温度降至610K重复上述实验,平衡后H2O(g)的体积分数为0.02。
COS(g)+H2O(g),在620K时将0.1mol的CO2(g)与0.4molH2S加入体积为2.5L的空钢瓶中,平衡后H2O(g)的体积分数为0.03,将温度降至610K重复上述实验,平衡后H2O(g)的体积分数为0.02。
(1)下列可判断反应达到平衡的是_____________。
a.v正(H2S)=v正(COS) b.容器内压强不再变化
c.c(H2S)/c(COS)不再变化 d. v正(H2S)=v逆(COS)
(2)620K时H2S的平衡转化率a=_______%,该反应的平衡常数表达式为K=____________;
(3)该反应的ΔH _____0。(填“>”、“<”或“=”)。
(4)一定可以提高平衡体系中H2O的体积分数,又能加快反应速率的措施是_____________。
a.减少COS的浓度 b.增大H2S浓度 c.加入催化剂 d.增大压强 e.升温
(5)610K时平衡后,t时刻往钢瓶中充入不参与反应的气体并保持压强不变而使体积加倍,请画出从t时刻后一段时间内的速率时间图像。_______________

【答案】 cd 3.75 ![]() > e
> e 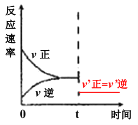
【解析】(1)a项,v正(H2S)=v正(COS),逆反应速率未知,不知道正逆反应速率是否相等,不能判断反应是否达到平衡,故a错误;b项,该反应在恒容容器中进行,且为气体分子数不变的反应,所以容器内压强始终不变,不能通过压强判断反应是否达到平衡,故b错误;该反应只要没有达到平衡,反应物和生成物的浓度就会发生变化,c(H2S)/c(COS)就会变化,当c(H2S)/c(COS)不再变化时说明反应已经达到平衡,故c正确;d项,用不同物质表示的速率数值之比等化学计量数之比,所以v正(H2S)=v正(COS),又因为v正(H2S)=v逆(COS),所以正(COS)=v逆(COS),反应达到平衡,故d正确。
(2)由化学方程式可得,该反应气体的物质的量不变,在620K时将0.1mol的CO2(g)与0.4molH2S加入体积为2.5L的空钢瓶中,H2S的平衡转化率为a,则平衡后反应的H2S为0.4a,生成的H2O(g)为0.4a,气体总物质的量仍为0.1mol+0.4mol=0.5mol,因为平衡后H2O(g)的体积分数为0.03(体积分数等于物质的量分数),所以0.4a÷0.5=0.03,解得:a=0.0375=3.75%。因为化学平衡常数表示各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值,所以该反应的平衡常数表达式为K=![]() 。
。
(3)因为将温度降至610K重复上述实验,平衡后H2O(g)的体积分数为0.02<0.03,所以降温不利于平衡正向移动,故该反应的正向为吸热反应,ΔH>0。
(4)a.减少COS的浓度,平衡右移,能提高H2O的体积分数,但反应速率减慢,故a错误;b.增大H2S浓度,化学反应速率加快,平衡右移,H2O的物质的量增大,但总物质的量也增大,因此不一定能提高平衡体系中H2O的体积分数,故b错误;c.加入催化剂能加快反应速率,但平衡不移动,不能提高平衡体系中H2O的体积分数,故c错误;d.增大压强,不一定能提高平衡体系中H2O的体积分数,也不一定能加快反应速率,例如:充入稀有气体使压强增大,不改变反应速率和化学平衡状态,故d错误;e.升温,化学反应速率加快,因为该反应正向吸热,所以平衡正向移动,提高了平衡体系中H2O的体积分数,故e正确。
(5)由化学方程式可得,该反应气体分子数不变,充入不参与反应的气体并保持压强不变而使体积加倍,则化学反应速率减慢,平衡不移动,因此速率时间图像为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能够引起反应速率增大的是
A. 将容器的体积缩小一半
B. 增加C的量
C. 保持体积不变,充入N2使体系压强增大
D. 保持压强不变,充入Ar使容器容积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中发生反应: A(s) +2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)明矾可用于净水,原因是(用离子方程式表示):_______________________。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________________________。
(2)用离子方程式表示泡沫灭火器灭火原理:_______________________________。
(3)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):________________。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是____________________。
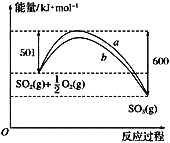
(5)如图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com