
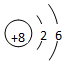 、
、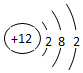
分析 氧原子的核外有8个电子;镁原子的核外有12个电子.
(1)氧原子的核外有8个电子,最外层有6个电子;
(2)氧元素和镁元素形成的化合物为氧化镁;
(3)通过氧原子和镁原子的原子结构示意图可知,核外电子运动是分层的.
解答 解:氧原子的核内有8个质子,核外有8个电子,故原子结构示意图为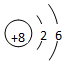 ;镁原子的核内有12个质子,而核外有12个电子,故原子结构示意图为
;镁原子的核内有12个质子,而核外有12个电子,故原子结构示意图为 .故答案为:
.故答案为: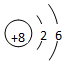 ;
; ;
;
(1)氧原子的最外层有6个电子,故容易得电子,有强氧化性,故答案为:得、氧化性;
(2)氧元素与镁元素形成化合物为氧化镁,化学式为MgO,故答案为:MgO;
(3)通过氧原子和镁原子的原子结构示意图可知,核外电子运动是分层的,故答案为:原子核外电子分层排布运动.
点评 本题考查了原子结构示意图的书写,难度不大,应注意的是当最外层电子数多于4个时,原子容易得电子,显示氧化性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | CO2的比例模型: | |
| B. | 甲烷的电子式 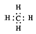 | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子构成${\;}_6^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和Na2CO3溶液除去CO2中混有的HCl气体 | |
| B. | 用量筒量取20.83mL12mol/L的浓硫酸配制250mL1mol/L稀硫酸 | |
| C. | 用浓硫酸干燥CO2、SO2、HI等酸性气体 | |
| D. | 用稀HNO3能鉴别Mg、Na2CO3、NaAlO2、Na2SiO3四种固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液,反应后进行过滤、洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
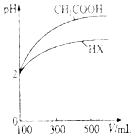 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3x10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、HBr、HI的热稳定性依次增强 | B. | KOH的碱性比NaOH的碱性强 | ||
| C. | HBrO4酸性比HClO4强 | D. | Na的金属性比Al的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
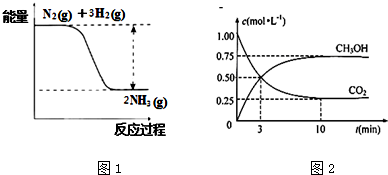
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com