
| A. | KCl | B. | CaCl2 | C. | BaCl2 | D. | AlCl3 |
分析 先假设13.5g全部是氯化铜,根据化学方程式计算出生成沉淀的质量,如果实际生成的沉淀质量<假设13.5g全部是氯化铜时生成的沉淀质量,则说明杂质物质中氯元素的质量分数要小于氯化铜中氯元素的质量分数.
解答 解:设13.5g氯化铜完全反应生成氯化银的质量为x,
CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2
135 287
13.5g x
则$\frac{135}{287}$=$\frac{13.5g}{x}$
解得:x=28.7g,
13.5g氯化铜完全反应生成沉淀质量28.7g>28g,因此,氯化铜中应混有相同质量氯化物与硝酸银反应生成沉淀氯化银质量小于氯化铜的杂质,即所含杂质中氯元素质量分数小于氯化铜;
氯化铜中铜、氯元素质量比=64:71,
A.KCl中K、Cl质量比=39:35.5=78:71>64:71,Cl的质量分数小于氯化铜,满足条件,故A正确;
B.CaCl2中Ca、Cl元素的质量比为40:71<64:71,则氯化钙中氯元素的质量分数大于氯化铜,不满足条件,故B错误;
C.BaCl2中Ba、Cl元素质量比=137:71>64:71,Cl的质量分数小于氯化铜,满足条件,故C正确;
D.AlCl3中Al、Cl元素质量比=27:106.564:71,则氯化钙中氯元素的质量分数大于氯化铜,不满足条件,故D错误;
故选AC.
点评 本题考查混合物的计算,题目难度中等,解答时注意先通过假设样品为纯净物计算反应所产生沉淀质量与实际沉淀质量对比,利用平均值的方法判断杂质所满足条件,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 101kPa时,H2(g)+1/2O2(g)═H2O(g)△H=-248kJ•mol-1,H2的燃烧热为248kJ•mol-1 | |
| B. | 利用盖斯定律可以计算难以测量的反应热 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的氢氧化钠的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 相同条件下,如果1 mol H原子所具有的能量为E1,1 mol H2所具有能量为E2,则2E1=E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
| C | FeCl3+3KSCN?Fe(SCN)3+3KCl 平衡体系中加入少量KSCN固体,溶液颜色加深 | 恒温时增大反应物浓度,平衡向正反应方向移动 |
| D | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. |  图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  图表示0.100 0 mol•L-1NaOH溶液滴定20.00 mL 0.100 0 mol•L-1醋酸溶液得到的滴定曲线 | |
| D. |  表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状.图中每个“•”代表一种元素,其中①代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状.图中每个“•”代表一种元素,其中①代表氢元素.下列说法不正确的是( )| A. | ①~⑦所代表的元素中,共有2种金属元素,5种非金属元素 | |
| B. | ③④⑤代表的元素所形成的化合物中,某些化合物可使酸性高锰酸钾溶液褪色 | |
| C. | ①~⑦所代表的元素中,元素④所形成的简单离子半径最大 | |
| D. | 气态氢化物的沸点及稳定性元素④比⑦好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
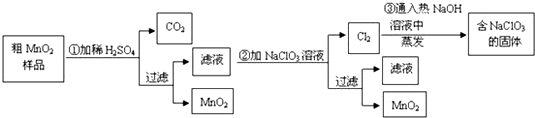
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、地热能等新能源 | |
| B. | 大力开采煤、石油和天然气,以满足人们日益增长的能源需求 | |
| C. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 | |
| D. | 减少资源消耗,注重资源的重复使用、资源的循环再生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com