
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
分析 Br元素的化合价降低,As元素的化合价升高,根据原子守恒和得失电子守恒可知,8KBrO3+4H2SO4+5AsH3=5H3AsO4+4K2SO4+4H2O+4Br2,结合氧化还原反应中基本概念及转移电子解答.
解答 解:反应的方程式应为8KBrO3+4H2SO4+5AsH3=5H3AsO4+4K2SO4+4H2O+4Br2,
A.Br元素的化合价降低,反应中KBrO3得电子作氧化剂,故A正确;
B.KBrO3得电子作氧化剂,反应中AsH3为还原剂,氧化剂和还原剂的物质的量比为8:5,故B错误;
C.反应中AsH3为还原剂,Br2为还原产物,则还原性AsH3>Br2,故C正确;
D.0.2mol KBrO3在反应中得到1mol电子,故D正确.
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意从电子守恒及化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
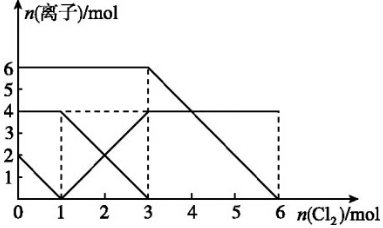
| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3 mol | |
| C. | 当通入1mol Cl2时,溶液中已发生的反应为2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ | B. | H+ | C. | Cu2+ Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 加入盐酸的体积 | 沉淀质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 180mL | 5.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3COOCH2CH3$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com