
【题目】某温度下,等体积、PH相同的盐酸和醋酸溶液分别加水稀释,溶液中的随溶液体积变化的曲线如图所示。据图判断下列说法正确的是

A.b点酸的总浓度大于a点酸的总浓度
B.b点溶液的导电性比c点溶液的导电性弱
C.取等体积的a点、b点对应的溶液,消耗的NaOH的量相同
D.曲线Ⅰ表示的是盐酸的变化曲线
【答案】D
【解析】
A. a、b两点相比,氢离子浓度a>b,据此判断;
B.溶液的导电性和离子的浓度有关,离子浓度越大导电性越强;
C. a为醋酸,b为盐酸,氢离子浓度不同;
D. 等体积、PH相同的盐酸和醋酸溶液c(H+)相同,加水稀释后盐酸中c(H+)变化大于醋酸溶液中c(H+),由此分析。
A. a、b两点相比,氢离子浓度a>b,氢离子浓度相同的盐酸和醋酸相比醋酸的浓度大于盐酸,b点酸的总浓度小于a点酸的总浓度,A项错误;
B. 溶液的导电性和离子的浓度有关,离子浓度越大导电性越强,故b点溶液的导电性比c点溶液的导电性强,B项错误;
C. a为醋酸,b为盐酸,氢离子浓度不同,取等体积的a、b两点对应的溶液,消耗氢氧化钠溶液的量不同,C项错误;
D. 等体积、PH相同的盐酸和醋酸溶液c(H+)相同,加水稀释后盐酸中c(H+)变化大于醋酸溶液中c(H+),故曲线I盐酸,曲线II是醋酸;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在光照条件下,等物质的量的![]() 与
与![]() 充分反应,只能生成
充分反应,只能生成![]() 和
和![]()
B.对石油分馏产品进行催化裂化,可以提高汽油等轻质油的产量和质量
C.乙炔能使酸性高锰酸钾溶液和溴水褪色,两者褪色的原理不同
D.邻二甲苯只有一种结构,说明苯中的碳碳键是完全相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3 催化还原法:原理如图所示

①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________。
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________。

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
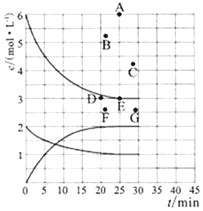
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)N2O4(g) H=-56.9kJmol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____________。
②已知该反应v正(NO2)=k1c2(NO2),v逆(N2O4)=k2c(N2O4),其中k1、k2为速率常数,则373K时,![]() =_________;改变温度至T1时,k1=k
=_________;改变温度至T1时,k1=k
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机反应中,反应物相同而条件不同,可得到不同的主产物,下式中R代表烃基,副产物均已略去

(请注意H和Br所加成的位置)
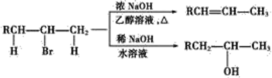
请写出下列转变的各步反应的化学方程式,特别注意要写明反应条件。
(1)由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3____________________。
(2)由(CH3)2CHCH=CH2分两步转变为(CH3)2CHCH2CH2OH________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定是一种化学实验操作也是一种定量分析的手段。它通过两种溶液的定量反应来确定某种溶质的含量。实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,其操作过程为:
①准确称取2.040g邻苯二甲酸氢钾加入250mL锥形瓶中;
②向锥形瓶中加30mL蒸馏水溶解;
③向溶液中加入1~2滴指示剂;
④用氢氧化钠溶液滴定至终点;
⑤重复以上操作;
⑥根据两次实验数据计算氢氧化钠的物质的量的浓度。
已知:Ⅰ、到达滴定终点时,溶液的pH值约为9.1。
Ⅱ、邻苯二甲酸氢钾在水溶液中可以电离出一个H+
Ⅲ、邻苯二甲酸氢钾的相对分子质量为204
指示剂 | 酚酞 | 甲基橙 | ||||
pH范围 | <8.2 | 8.2 ~ 10 | >10 | <3.1 | 3.1 ~ 4.4 | >4.4 |
颜色 | 无色 | 粉红色 | 红色 | 红色 | 橙色 | 黄色 |
(1)为标定氢氧化钠溶液的浓度,应选用___________作指示剂;
(2)判断到达滴定终点的实验现象是___________________________________________;
(3)滴定结束消耗NaOH溶液体积为10.00ml,则NaOH溶液的浓度为______________;
(4)滴定过程中,下列操作能使测定结果(待测液的浓度数值)偏小的是_________。
A.上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解
B.滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失
C.滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外
D.滴定前仰视读数而滴定终了俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是 ( )

A. X、Y、Z三种元素中,X的非金属性最强
B. 常压下X的单质的熔点比Z的低
C. Y的最高正化合价为+7
D. Y的氢化物的稳定性比Z的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有镁、铜、铝三种金属,现取10.0g 该铝合金,向其中加入100mL 3.0mol/L 氢氧化钠溶液,氢氧化钠溶液恰好完全反应,请计算:
(1)该铝合金中铝的质量分数________
(2)生成标准状况下的氢气的体积是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com