
(19分)
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知: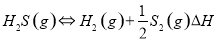 在恒容密闭容器中,控制不同温度进行H2S分解实验。
在恒容密闭容器中,控制不同温度进行H2S分解实验。
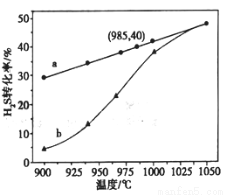
以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。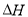 _____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
_____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
②电化学法
该法制氢过程的示意图如图。反应池中反应的离子方程式是___________________;
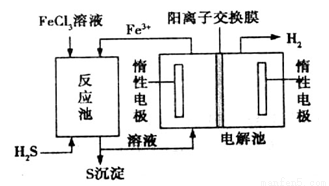
反应后的溶液进入电解池,电解总反应的离子方程式为________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式_______________________________________________。
②电池总反应的化学方程式_________________________________________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KmnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液__________________________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
(19分)
(1)① >(2分),温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡) (2分)
②2Fe3+ + H2S== 2Fe2++S↓+2H+(2分)
2Fe2+ + 2H+ 2Fe3++H2↑(2分)
2Fe3++H2↑(2分)
(2)①Al-3e- + 4OH- =[Al(OH)4]- (或AlO2-+2H2O ) (2分)
②Al+3NiO(OH)+ H2O+ OH-= 3Ni(OH)2+ AlO2-; (2分)
(3)①由无色变为紫红色(2分)
② A C (2分)
③86.25%(3分)
【解析】
试题分析:(1)①温度升高,反应物的转化率增大,说明升高温度,平衡正向移动,所以△H>0;随温度的升高,曲线b向曲线a靠近,是因为温度升高,反应速率加快,达到平衡的时间缩短;
②反应池中是硫化氢与氯化铁发生的氧化还原反应,生成亚铁离子和S单质及氢离子,离子方程式是2Fe3+ + H2S== 2Fe2++S↓+2H+;得到的溶液为氯化亚铁和氯化氢进入电解池,则电解氯化亚铁和氯化氢的混合液得到氢气和氯化铁,所以电解池中发生反应的离子方程式是2Fe2+ + 2H+ 2Fe3++H2↑;
2Fe3++H2↑;
(2)①以Al和NiO(OH)为电极,NaOH溶液为电解液组成的电池中,Al失去电子发生氧化反应,作电池的负极,结合电解质溶液,所以负极的电极反应式为Al-3e- + 4OH- = AlO2-+2H2O;
②正极是NiO(OH)转化为Ni(OH)2,电极反应式是NiO(OH)+ e- + H2O= Ni(OH)2+ OH-,根据得失电子守恒,将正负极的电极反应式相加,所以电池的总反应是Al+3NiO(OH)+ H2O+ OH-= 3Ni(OH)2+ AlO2-;
(3)①滴入最后一滴酸性KMnO4溶液,溶液由无色变为浅红色,30秒内不恢复,可判断达到滴定终点;
②第一组数据偏大,可能是酸式滴定管用蒸馏水洗净后未用标准液润洗,造成高锰酸钾溶液的浓度降低,消耗高锰酸钾溶液的体积偏大;或者是滴定终了仰视读数,使读取数值偏大,锥形瓶未干燥,对结果无影响,所以答案选AC;
③由于第一组数据偏大,故舍去,取后三组数据,消耗高锰酸钾溶液的体积平均为20.00mL,所以亚硝酸钠的质量是20.00×10-3L×0.1000mol/L×5/2×250/25×69g/mol=3.45g,则固体中亚硫酸钠的质量分数是3.45g/4.000g×100%=86.25%。
考点:考查氧化还原反应的分析,化学平衡的判断,滴定终点的判断,误差分析,质量分数的计算


科目:高中化学 来源:2014-2015学年四川省眉山市高三第一次诊断性考试理综化学试卷(解析版) 题型:填空题
(14分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为____,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示
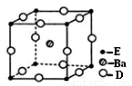
该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:填空题
(11分)有关短周期元素X、Y、Z、M、N的信息如下:
元素 | 有关信息 |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素 |
Z | Z元素的单质在X元素的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
M | M元素的最高价氧化物对应的水化物能与M元素的最简单气态氢化物反应生成盐R |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)Z元素在第____ 周期第 族。
(2)Y元素的简单阴离子结构示意图为 ,Y与Z元素的气态氢化物稳定性顺序为____>(写化学式)。
(3)化合物N2X2与CO2反应的化学方程式为 。
(4)盐R中含有的化学键类型有 。盐R的水溶液显酸性,用离子方程式表示其盐溶液显酸性的原因为 。
(5)电解盐NY水溶液的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省晋中市高三1月考前适应性训练理综化学试卷(解析版) 题型:填空题
(15分)倡导“低碳经济”。降低大气中CO2的含量,有利于解决气候变暖的环境问题。
(1)工业上可用CO2来生产燃料甲醇。反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0.
CH3OH(g)+H2O(g) △H<0.
一定温度下,在体积为2L的恒容密闭容器中,充入2molCO2和6molH2.一定条件下发生反应:测得CO2和CH3OH的浓度随时间变化如图所示。
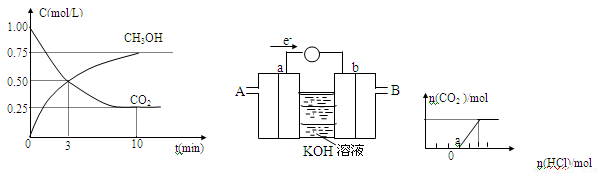
①达到平衡时,CO2的转化率= 。
②从反应开始到平衡。氢气的平均反应速率V(H2)= mol/(L·min)。
③容器内的平衡压强与起始压强之比为 。
④保持容器容积不变,下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
⑤某同学依据甲醇燃烧的反应原理,设计如上图所示的电池装置,a、b均为惰性电极。使用时,空气从 口通入(填“A”或“B”):a极的电极反应式为 。
(2)将一定量的CO2气体通入NaOH溶液中,再向所得溶液中逐滴加入盐酸,边加边振荡至过量,产生的气体与HCl物质的量关系如上图所示(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中溶质的化学式 ,a点溶液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省晋中市高三1月考前适应性训练理综化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的值。下列说法错误的是
A.30g甲醛(CH2O)与30g葡萄糖均含有NA个碳原子
B.0.1molCl2与过量稀NaOH 溶液作用转移电子数0.2NA
C.常温下,1L pH=1的硫酸由水电离出的H+ 约为1×10-13NA
D.石墨电极电解CuSO4 溶液,阴极上有4mol电子转移,阳极上有NA个O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
.绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是
A.甲烷与氯气反应制氯仿:CH4+3Cl2  CHCl3+3HCl
CHCl3+3HCl
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2 RCH2CH2CHO
RCH2CH2CHO
C.甲烷、CO合成乙酸乙酯:2CH4+2CO  CH3COOCH2CH3
CH3COOCH2CH3
D.乙烯合成聚乙烯


查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:填空题
17.⑴(9分)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 ,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
①请写出方框内物质的化学式: 。
②针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
③若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:计算题
(8分)由Na2CO3·nH2O与NaHCO3组成的混合物28.2 g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况下的气体3.36 L;若将28.2 g原混合物与盐酸反应,则放出标准状况下气体4.48 L,由此计算。
(1)残留固体质量;
(2)n值;
(3)NaHCO3质量。(写出计算求解的过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:选择题
能正确表示下列离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32—+H2O
B.铜与浓硫酸混合加热:Cu+2H2SO4(浓)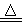 Cu2++SO42—+2H2O+SO2↑
Cu2++SO42—+2H2O+SO2↑
C.过量的浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
D.明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO SO42—+2Ba2++3OH- = 2BaSO4↓+Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com