
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: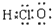 | |
| D. | NaCl的电子式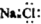 |
分析 A.四氯化碳中存在4个碳氯共价键,碳原子和氯原子都达到8电子稳定结构;
B.氟化氢为共价化合物,分子中不存在阴阳离子;
C.次氯酸中不存在氢氯键,分子中存在1个氧氢键和一个氧氯键;
D.NaCl为离子化合物,由钠离子与氯离子构成.
解答 解:A.四氯化碳的电子式为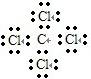 ,碳原子和氯原子的最外层都达到8电子稳定结构,故A正确;
,碳原子和氯原子的最外层都达到8电子稳定结构,故A正确;
B.氟化氢分子中不存在阴阳离子,氟化氢正确的分子式为 ,故B错误;
,故B错误;
C.次氯酸中不存在氢氯键,次氯酸正确的电子式为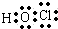 故C错误;
故C错误;
D.NaCl为离子化合物,由钠离子与氯离子构成,电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式、元素符号的表示方法判断,题目难度中等,注意掌握电子式、元素符号等化学用语的概念及正确的表示方法,明确离子化合物与共价化合物的判断方法及电子式的区别.


科目:高中化学 来源: 题型:选择题
| A. | 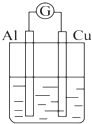 NaOH溶液 | B. | 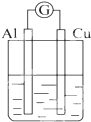 稀硫酸 | C. | 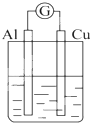 稀硝酸 | D. | 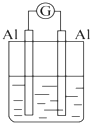 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中混合气体的密度不变 | B. | 密闭容器中c(NH3):c(CO2)=2:1 | ||
| C. | 2v(NH3)=v(CO2) | D. | 密闭容器中氨气的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和乙醇的混合液(3:1)加热至140℃ | |
| B. | 浓硫酸和苯的混和液加热至80℃ | |
| C. | 煮沸氯乙烷和苛性钾溶液 | |
| D. | 煮沸氯乙烷和苛性钾的醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
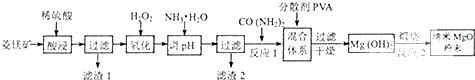
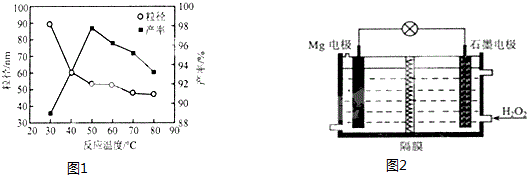
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com